Inscription / Connexion Nouveau Sujet
Dosage indirect des ions cuivres par iodométrie
Bonjour je travaille sur l'oxydoréduction en phase aqueuse et je ne comprends très bien la partie 1 de cet exercice:
Partie 1: Etude de la stabilité du cuivre(I) en solution aqueuse
a) A l'aide des données, montrer que l'ion cuivre(I) est instable à pH = 0.
b) L'oxydation des ions iodure par les ions cuivre(II) est-elle a priori possible ?
c) En fait, les ions iodure forment avec les ions cuivre(I) un précipité d'iodure de cuivre(I) (Ks(CuI) = 10-12 à 298 K).
Ecrire la demi-équation redox mettant en jeu le couple Cu2+(aq)/CuI(s) et calculer son potentiel standard. Si l'on n'arrive pas à résoudre cette question, on admettra la valeur, soit 0,89 V.
d) Le potentiel standard du couple CuI(s)/Cu(s) est égal à - 0,20 V à 298 K.
Montrer que les ions cuivre(I) sont stabilisés en présence d'iodure.
e) Quelle réaction se produit donc lorsque l'on mélange des ions cuivre(II) et des ions
iodure en solution dans les conditions standard ? Ecrire l'équation bilan.
Partie 2 : Réalisation du dosage indirect des ions cuivre(II) par iodométrie
a) Pour réaliser le titrage, on se place en excès d'ions iodure et on dose le diiode formé
I2(aq) par l'ion thiosulfate S2O32-. Ecrire la réaction entre l'ion thiosulfate et le diiode.
b) On prélève 20,0 mL de la solution 1, on ajoute 50 mL d'une solution d'iodure de
potassium de concentration 2,00.10-1 mol.L-1. On dose le diiode formé par une solution de thiosulfate de sodium de concentration 2,50.10-2 mol.L-1. Ce dosage nécessite 13,50 mL de thiosulfate.
Quel indicateur coloré utilise-t-on pour visualiser l'équivalence ?
c) Déterminer la concentration c1 de la solution 1.
d) Vérifier que le système est bien en excès d'ions iodure.
e) Calculer le pourcentage en masse de cuivre dans le laiton et conclure
Pour la question 1 a) j'ai bien montré l'incohérence des potentiels standards et le fait que Cu+ se dismute donc en Cu2+ et Cu(s)
Pour la b) la réaction n'est pas favorisé thermodynamiquement en vu des potentiels standards
J'ai fait la c) et j'ai trouve 0,89V
A partir de la d) je ne comprends pas trop...
Pouvez vous m'aider? (Merci d'avance!)
Voici les données de l'exercice:
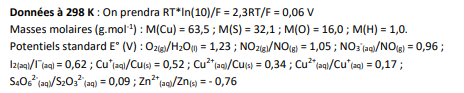
Bonsoir
Pour d) : as-tu essayé de placer sur un axe des potentiels le potentiel du couple faisant intervenir CuI ?
Oui j'ai bien compris que Cu2+ +Cu +2I- = 2CuI et que Cu2+ et Cu viennent de la dismutation d'ou le fait que la réaction est indirect
C'est bien cela ; le cuivre au degré d'oxydation (+I) est stable en présence d'ions iodure. Il ne se dismute pas.
Mais pourquoi les ions iodures stabilisent stabilisent le cuivre I? (je veux dire comment l'expliquer?)
Et du coup qu'est qu'il se passe quand on mélange les ions cuivre(II) et les ions
iodure en solution dans les conditions standard ?
Ca va donner du CuI? Ca me parait bizarre...
Reprends les couples qui interviennent. En présence d'ions iodure, les ions Cu2+ réagissent sur le cuivre métal pour produire CuI.
Non ! Dans ton message du 13-01-21 à 19:37 tu as fourni la bonne équation. La règle du gamma montre que cette réaction est quasi totale. La réaction inverse de dismutation de CuI ne se produit donc pas. CuI est donc stable dans l'eau vis à vis de la dismutation alors que, comme tu l'as montré précédemment Cu+ est instable dans l'eau : il se dismute.


