Inscription / Connexion Nouveau Sujet
Dosage du sel ferreux par le permanganate en milieu phosphorique
Bonjour,
Je vais faire un TP sur un dosage du sel ferreux par le permanganate en milieu phosphorique et j'aimerais savoir si :
- certains d'entre vous ont une idée de la courbe à obtenir
(il faudra tracer les courbes à certains pH quand il y a de la soude ou de l'acide sulfurique ou de l'acide phosphorique avec de l'acide sulfurique)
- pourquoi on travaille en milieu phosphorique
- avez-vous une idée des équations théoriques dans ces cas ?
Bonne soirée,
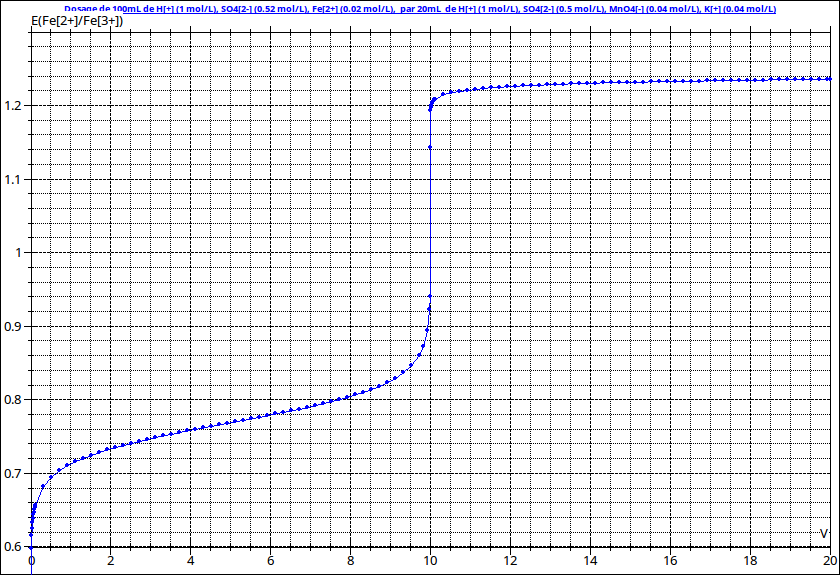
Voici un exemple de courbe potentiométrique correspondant au dosage d'une solution de sulfate de fer(II) par une solution de permanganate de potassium. On remarque un saut de potentiel extrêmement "brutal" à l'équivalence, beaucoup plus que lors d'un dosage acide-base par pHmétrie.
Il faut travailler en milieu très acide pour deux raisons essentielles :
1° La réaction consomme des ions oxonium (je te laisse écrire les demies équations...)
2° il faut éviter la précipitation des ions fer(II) et surtout fer(III) sous forme d'hydroxydes Fe(OH)2 et Fe(OH)3 ; cette précipitation se produit pour pH>3 environ (cela dépend de la concentration en ions fer...)
Pour simplifier les calculs et l'interprétation, il est intéressant de travailler avec un acide nettement plus concentré que la solution à titrer. On peut ainsi considérer le pH comme pratiquement constant au cours du dosage. J'ai choisi ici d'introduire dans les deux solutions de l'acide sulfurique de façon que le pH reste voisin de zéro au cours du dosage.
Renseignements complémentaires ici : ![]()
Remarque complémentaire : il est possible de réaliser des solutions tampons à partir de mélanges entre l'acide orthophosphorique et ses bases conjuguées. Comme déjà expliqué, travailler à pH fixe simplifie les calculs ici...
Je t'ai (de façon très partielle j'en conviens) répondu : cet acide peut servir à fabriquer une solution tampon de sorte qu'il soit possible de considérer le pH comme constant au cours du dosage. Cela simplifie les calculs.
Difficile d'en dire plus sans précisions supplémentaires !


