Inscription / Connexion Nouveau Sujet
Dosage de l'éthanol
Bonsoir,
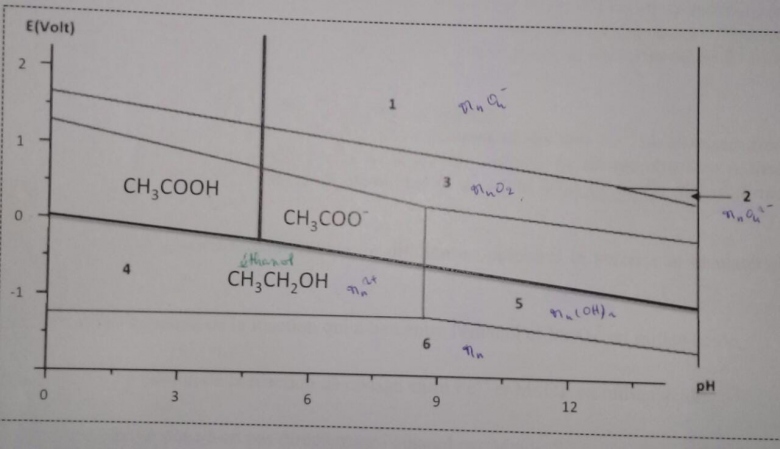
Dans un exercice, pour doser la quantité d'éthanol dans un carburant on a l'a d'abord oxydé en milieu acide par les ions permanganate, puis on a dosé l'excès de par les ions ferreux. Ce que je n'arrive pas à comprendre est pourquoi on effectue la première réaction en milieu acide?
Voici le diagramme E-pH fourni avec l'exercice:
Bonsoir
Un milieu acide évite la formation de précipité d'hydroxyde de manganèse. La présence de ce précipité marron rendrait imprécise le changement de couleur due à la disparition des ions permanganate de couleur violette.
Ce milieu acide est aussi très important pour le dosage des ions permanganate restants par les ions fer (II). Sinon les ions fer (II) conduisent à un précipité d'hydroxyde de fer(II) vert foncé et les ions fer (III ) formés conduisent à un précipité d'hydroxyde de fer (III ) de couleur rouille oranger.


