Inscription / Connexion Nouveau Sujet
Dosage d'un acide triprotique
Bonsoir à tous,
J'ai quelques difficultés à résoudre le problème suivant:
On titre 10 ml d'acide phisporique par 0.1M par NaOH 0.1M. Calculer le pH après addition de 0,5,10,15,25 et 35 ml de base.
Pka1 =2
Pka2 = 6.8
PKa3 = 12
Pour le pH de départ c'est ok.
Ajout de 5 ml de NaOH 0.1M
J'ai au départ de
auquel j'ajoute
mole de NaOH
La réaction est la suivante
En faisant un bilan de matière il me reste dans le milieu
mole de et
mole de
D'après moi on a un tampon et les concentration de l'acide et la base conjugué étant égales le rapport de ceux-ci vaut 1 et pH=pKa1 = 2
Dans le cours il est noté 2.18 ...je ne vois pas vraiment comment on trouve se résultat
Après ajout de 15 ml et en suivant la même logique que précédemment on obtient encore un tampon avec les espèces suivantes
pH = pKa2 = 6.18
Quand on ajoute 25 ml, on se retrouve avec les espèces suivantes :
D'après moi là encore on a un tampon avec de
et
mole de
ce qui constitue encore un tampon et donc pH = pKa3 = 12 et dans mon cours j'ai 11.69
Pour finir je me demandais ce qui se passe quand je dépasse la 3 ème équivalence, est-ce que je dois tenir compte de la concentration des ions et travailler comme si je mélangeais une base forte avec une base faible ...
Si quelqu'un peut me donner quelques pistes et me dire ce qui cloche dans les calculs ...
Bonjour
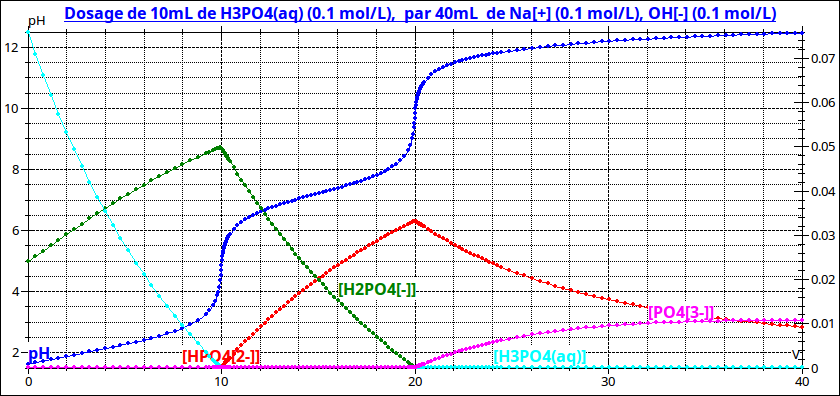
Il s'agit de doser 10mL d'une solution d'acide phosphorique à 0,1mol/L par une solution de soude à 0,1mol/L. Selon le "Handbook" qui fait référence à l'échelle internationale concernant les constantes physiques, les 3 pKa à 25°C sont respectivement :
2,16
7,21
12,32
Que ton corrigé propose 2,18 à la première demie équivalence, compte tenu des incertitudes sur les mesures, ne me parait pas choquant. Pour la seconde équivalence, on obtient pH = pKa2=7,2
As-tu obtenu les pH à la première et à la seconde équivalence ?
La situation après la seconde équivalence se complique sérieusement : la réaction prédominante est alors celle que tu as indiquée mais sa constante vaut Ke/Ka3=101,7. Cette constante est de trop peu supérieure à 1 pour qu'il soit possible de considérer la réaction comme totale. Il faut remplir un tableau d'avancement et écrire que le pH est donné par la relation :
On n'obtient pas de "saut de pH" à la troisième équivalence et le pH à la troisième demie équivalence ne vaut pas pKa3.
Pour t'aider, voici la courbe représentant les variations de pH en fonction du volume de soude ajouté ainsi que les variations correspondantes des différentes concentrations. À toi de décrypter tout cela !