Inscription / Connexion Nouveau Sujet
Dosage acido basique d'une solution
Bonsoir,
On dispose d'une solution A de soude de concentration inconnue.on dose 30 cm3 de A par de l'acide chlorhydrique de concentration 0,1 mol.L-1. En présence de bleu de bromothymol.le virage du bleu au jaune a lieu pour 27,3 cm3 d'acide versé.Il en est même si l'indicateur est le phenopthaline et l'heliantine. La solution A est abandonnée plusieurs jours à l'air libre en vase ouvert. Après compensation de l'évaporation on obtient une solution B. Un dosage de 30 cm3 de Ben présence de phenopthaléine montre que le virage à lieu pour 20,1cm3 d'acide de concentration égale à 0,1mol.L -1.Un autre dosage en présence d'heliantine conduit à un virage pour 27,3 cm3 d'acide versé dans 303 de solution de B.
1-Quelle sont les espèces présent dans B? Calculer leur concentration
Je ne sais pas comment m'y prendre pour le calcul des concentrations et même le volume Total
Je pense que les espèces contenu dans B sont: H3O+,Le OH-,le Na+
Merci pour la réponse précédente
Bonjour
Le premier dosage est un classique dosage base forte par acide fort avec une équivalence à pH=7 d'où l'usage du bleu de bromothymol pour repérer le volume équivalent. Cependant, la courbe pH=f(Va) est quasi verticale entre pH=3 et pH=10 de sorte que l'usage de l'hélianthine ou de la phtaléine conduit, aux incertitudes de mesure près, quasiment au même volume équivalent.
Le deuxième dosage est le dosage par un acide fort de la soude carbonatée. Au contact de l'air atmosphérique, un peu du dioxyde de carbone présent dans l'air réagit sur les ions hydroxyde de la soude pour donner des ions carbonate CO32- ; ces ions se comportent en dibase. Je te laisse écrire l'équation de la réaction de formation de ces ions.
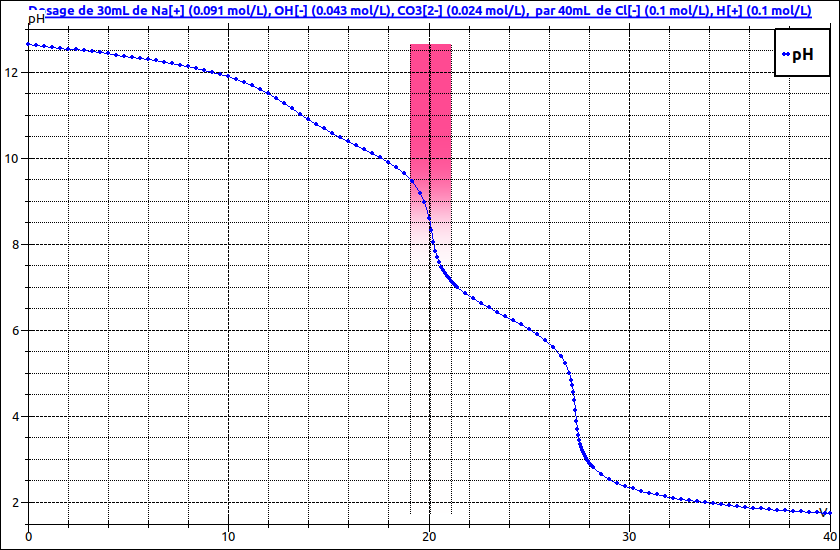
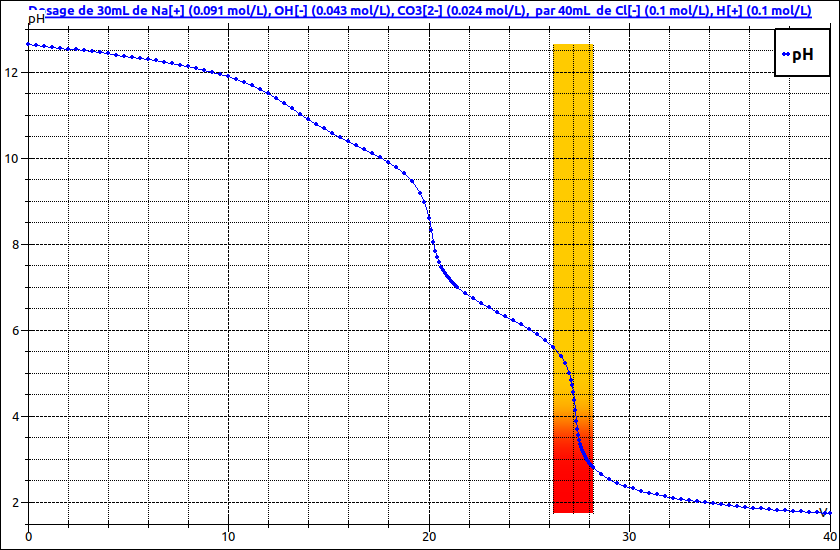
Le dosage de la soude carbonatée fait apparaître deux sauts de pH donc deux équivalences. La première équivalence correspond au dosage simultané des ions hydroxyde restants de la soude et de la première basicité des ions carbonate avec un pH équivalent voisin de 8. La seconde équivalence correspond au dosage de la deuxième basicité des ions carbonates ; équivalence pour pH voisin de 4,5.
Je te laisse réfléchir à tout cela, écrire les réactions de dosages et calculer leurs constantes d'équilibre puis faire les calculs demandés...
Voici la courbe montrant les deux sauts de pH avec le virage de la phénol-phtaléine puis de l'hélianthine.Toutes les concentrations sont indiquées. Tu peux t'auto-corriger mais pose des questions sur ce que tu ne comprends pas.