Inscription / Connexion Nouveau Sujet
Dosage acide sulfureux
Bonjour, je bloque sur un exercice de dosage, voici l'énoncé :
on veut doser 10 mL d'une solution d'acide sulfureux H2SO3 par une solution de soude NaOH de concentration CB=0.10 mol.L-1.
L'acide sulfureux H2SO3 se dissocie totalement dans l'eau.
On donne les KA des couples SO2/HSO3- (KA1 = 10-1,81) et HSO3-/SO32- (KA2 = 10-7,6.
1) S'attend-on à observer un ou deux sauts de pH ? Justifier votre réponse.
Le volume à la première équivalence, Veq1, vaut 10 mL. On pose x=V/Veq1.
J'ai mis qu'il y aurait deux sauts de pH car la différence des pkA est supérieure à 4
2) Calculer la concentration initiale CA en acide.
En utilisant CAVA = CBVeq1, je trouve CA = 0,1 M.
3) Donner l'expression du pH de la solution pour x=0 et en fonction de x pour 0 < x < 1.
C'est ici que je bloque pour x = 0, soit avant dosage.
J'ai tout d'abord écrit les différentes réactions prépondérantes, sachant qu'on a :
H2SO3 + 2H2O --> 2H3O+ + SO32-, soit la concentration de H3O+ qui est deux fois plus élevée que celle de CA (0,02 M).
Donc j'ai pour la réaction prépondérante :
H3O+ + SO32- --> H2O + HSO3-
K = 107,6 pour cette réaction, elle est quantitative, je trouve à la fin :
[H3O+] = 0,1M, [HSO3-] = 0,1 M et [SO32-] = 0.
Après j'ai une seconde réaction prépondérante :
H3O+ + HSO3- --> SO2 + H2O.
K = 101,81, réaction non quantitative, je trouve à la fin :
[H3O+] = [HSO3-] = 0,032 M et [SO2] = 0,068M.
Mais là, je ne sais pas ce qu'il faut faire ensuite, car si je continue j'ai la même réaction prépondérante à l'infini... Ai-je commis une erreur quelque part ?
Bonsoir
OK pour les deux premières questions. Ensuite :
Cas x = 0. L'énoncé demande de considérer, même s'il s'agit d'une simplification de la réalité, l'absence de molécules H2SO3. Il faut donc considérer la solution comme une solution de SO2 dissout qui se comporte comme un diacide et donc qui réagit sur l'eau selon deux réactions :
SO2(aq) + 2H2O = H3O+ + HSO3- : Ka1 = 10-1,81
HSO3- + H2O = H3O+ + SO32- : Ka2 = 10-7,6
En x=0, tu peux négliger l'influence de la seconde réaction compte tenu de l'écart de pKa et donc considérer la solution comme une solution de mono acide faible assez fortement dissocié, compte tenue de la valeur assez faible de pKa1.
Pour 0<x<1, on peut négliger la seconde acidité mais la situation est tout de même assez compliquée car la première acidité n'est ni forte ni très faible. Pour chaque valeur de x, il faut résoudre l'équation dont [H3O+] est solution puis en déduire le pH. Il n'existe pas de relation simple entre x et le pH mais, pour toute valeur de x, il est possible de déterminer le pH. En effet, les ions hydroxyde ajoutés réagissent à la fois sur les ions oxonium formés par la réaction de SO2 dissout sur l'eau et sur SO2 dissout. Vue la complexité de la situation, le plus simple est d'écrire la relation d'électro neutralité de la solution et la relation de conservation de l'élément soufre. C'est la façon la plus simple d'obtenir l'équation dont [H3O+] est solution.
Pour "t'auto corriger", voici une simulation de la courbe de titrage.
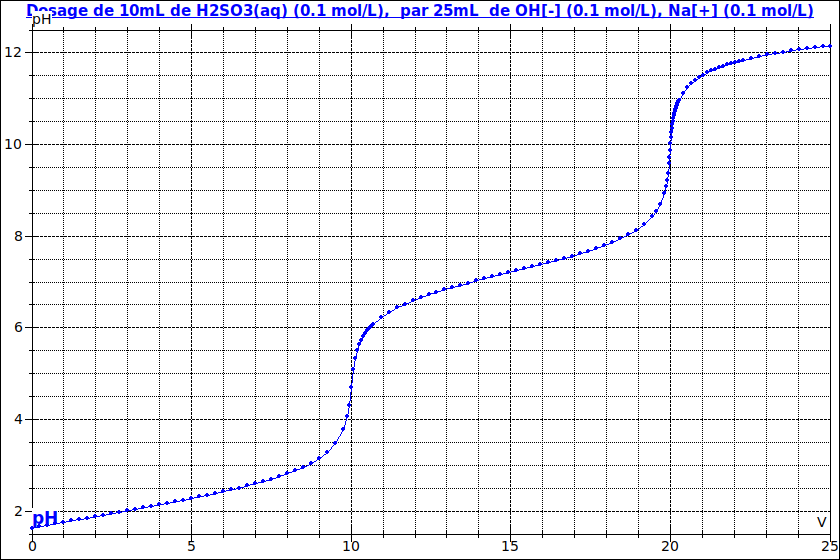
Merci pour l'aide !
Je pense que pour x = 0, c'est bon, mais pour 0<x<1, je ne comprends pas très bien ce que signifie :
la relation d'électro neutralité de la solution et la relation de conservation de l'élément soufre
Habituellement, lors d'un dosage, on considérait qu'il n'y avait pas de H3O+ au début de la réaction pour 0<x<1, je pensais alors à faire la réaction :
SO2 + OH- = H2O + HSO3-, mais je ne peux pas l'équilibrer.
Si j'ai bien compris dans ce cas, il faudrait faire :
H3O+ + OH- = 2H2O ?
Il faudrait tenir compte des deux réactions :
H3O+ + HO- = H2O K1=1014
SO2(aq)+HO- = HSO3- K2 = 1012,19
Dans le cas de plusieurs équilibres simultanées de constantes d'équilibre voisines, il est souvent plus rapide d'écrire les deux relations suivantes. Je note Ca=Cb=C=0,1mol/L
Va=10mL ; Vb=x.Ve=x.Va ;
1° : Électro neutralité : la solution contient autant de charge + que de charge -. Avant la première équivalence, on peut négliger la présence des ions HO- et des ions SO32- :
[Na+] + [H3O+] = [HSO3-]
avec :
2° : Conservation de l'élément soufre : les Ca.Va moles d'élément soufre introduites sont présentes soit sous forme de SO2(aq) soit sous forme de HSO3- :
En tenant compte de l'expression de Ka1 :
Soit en réinjectant dans l'expression de la conservation de l'élément soufre :
En reportant dans l'équation traduisant l'électro neutralité, on obtient une équation où la seule inconnue est la concentration en ions oxonium. On résout cette équation et on en déduit le pH. On peut se contenter de faire le calcul pour quelques valeurs de x telles que 0 < x <1.
Pour illustrer mes propos : j'ai ajouté à la courbe pH=f(V) les courbes correspondant aux variations en fonction de V des quantités présentes :
En rouge: quantité de SO2(aq)
en vert : quantité de HSO3-
en rose : quantité de SO32-
On voit bien que la situation avant la première équivalence est compliquée : l'intersection de la courbe rouge et de la courbe verte correspond à pH=pKa1 mais ne correspond pas à la première demie équivalence. Il faudrait d'ailleurs dans ce cas que la courbe verte corresponde pour V=0 à une quantité quasi nulle, ce qui est loin d'être le cas.
Pas de problème en revanche entre la première et la seconde équivalence. On tombe sur un classique : l'intersection de la courbe rose et de la courbe verte qui correspond à pH=pKa2 correspond aussi à la seconde demie équivalence.
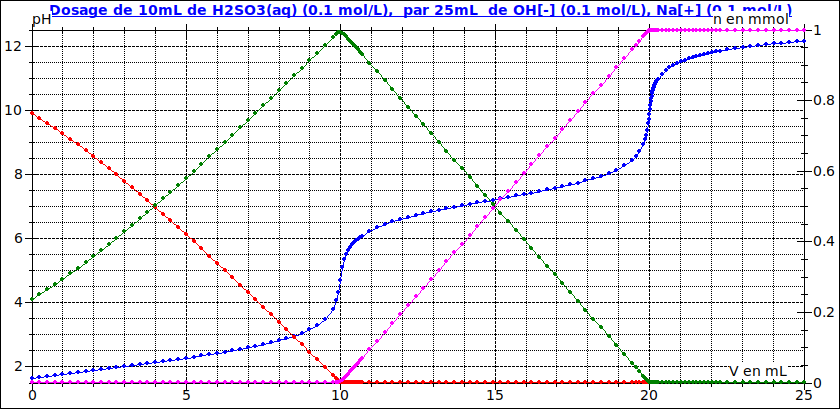
Je mets ce que j'ai trouvé pour chacune des situations possibles, normalement c'est ok, j'ai vérifié avec la courbe, pour 0<x<1 :
pH =
pour x = 1, on a :
pH = car il y a une amphotérisation de HSO3-.
pour 1<x<2 :
pH =
pour x = 2, on a :
SO32- + H2O = OH- + HSO3- et on trouve un pH de 10,06.
pour x>2, on a :
pH = .
Dernières questions : je n'avais jamais vu le cas 0<x<1 de cette manière en cours, ici il y a une sorte de compétition entre deux réactions. Est-ce que la méthode employée est générale ? (écrire l'électroneutralité et la conservation de la matière)
Est-ce que il y existerait d'autres dosages similaires ?
D'accord avec tout ce que tu as fait sauf pour le cas 0<x<1; l'expression que tu obtiens n'est pas homogène. En notant h la concentration en ions oxonium, la relation d'électro neutralité s'écrit :
Après mise au même dénominateur, tu obtiens une équation du second degré en h qu'il faut résoudre, pour quelques valeurs de x puis calculer les pH correspondants ; pas simple : il n'existe pas d'expression simple du pH en fonction de x...
Sinon : la méthode consistant à écrire la relation d'électro neutralité et les relations de conservation de la matière est la "méthode de secours", celle à utiliser dans les cas où il n'existe pas de réaction prépondérante.


