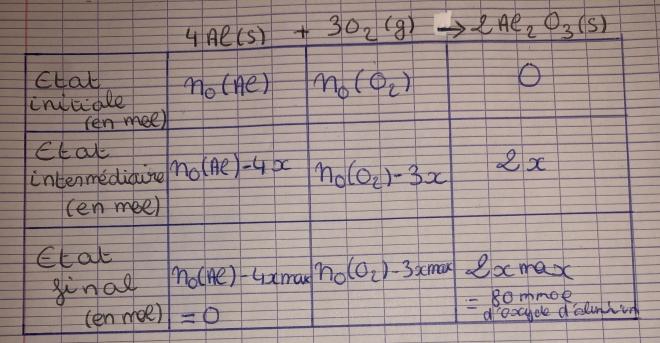Inscription / Connexion Nouveau Sujet
DM p-c tableau d’avancement
Bonsoir à tous, voilà l'exercice sur lequel je bloque: Le métal aluminium Al(s) réagit avec le dioxygène de l'air O2(g) pour former de l'oxyde d'aluminium Al2O3 (s) selon une transformation totale de l'équation: 4Al(s) + 3O2(g) —> 2Al2O3
Le métal d'aluminium est le réactif limitant et il s'est formé 80mmol d'oxyde d'aluminium. On note n0(Al) la quantité initiale d'aluminium et n0(O2) la quantité initiale de dioxygène.
1. Construire et compléter le tableau d'avancement associé à la réaction.
2. Exploiter la composition du système dans l'état final pour déterminer la quantité initiale d'aluminium n0(Al).
La question 1 je l'ai faite, mais je reste bloqué sur la 2 depuis cet après-midi, comment déterminer une quantité de matière si on a ni masse molaire ni masse. Merci d'avance
Pour avancer :
Question 1 :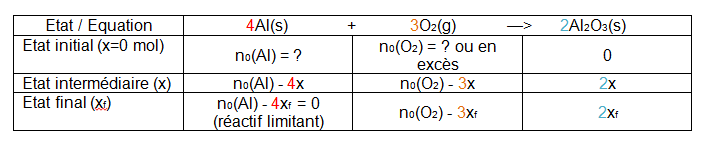
Question 2 :
Sachant que l'énoncé te fournit
Puis avec le tableau d'avancement, tu en déduis la quantité de matière initiale en aluminium 
Xf = 80/2 = 40mmol ?
Exactement !
Et donc, d'après ton tableau d'avancement :


Etant donné que je ne serai pas là le jour de ton contrôle, un moyen de vérifier la cohérence de ton résultat :
tu introduis la quantité de matière initiale en aluminium calculée puis tu déroules ton raisonnement pour retrouver la quantité de matière en oxyde d'aluminium fournie à l'état initial.
Je t'en prie mais essaie de poster plus tôt la prochaine fois, c'était tangent là 
N'hésite pas à nous faire de la pub !
A une prochaine fois !