Inscription / Connexion Nouveau Sujet
DM chimie : diacide ascorbique
bonjour
J'ai un devoir de chimie à faire, pourriez vous m'aider s'il vous plait ?
Nous nous intéressons dans un premier temps aux propriétés acido-basiques de l?acide ascorbique, qui possède deux pKa : pKa1 = 4, 2 et pKa2 = 11, 3 (données a` 298 K). Pour simplifier, cet acide sera noté ? AH2 dans la suite.
1. Rappeler la de ?finition d?un acide et d?une base au sens de Brønsted. Comment appelle-t-on un acide qui posse`de deux pKa ? Comment qualifier la force de l?acide ascorbique?
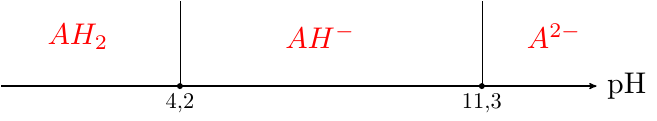
2. Tracer le diagramme de prédominance de l?acide ascorbique en fonction du pH et en déduire la forme prédominante au pH physiologique (pH = 7,4). évaluer grossièrement à quel pourcentage elle prédomine devant les autres formes.
On dissout 0,22 g d?acide ascorbique AH2 dans 250 mL d?eau. La solution obtenue a un pH de 3,2.
3.1. E ?crire l?e ?quation de la re ?action de dissociation de l?acide ascorbique dans l?eau correspondant a` la premie`re acidite ?. Exprimer le quotient de cette re ?action en fonction des activite ?s puis des concentrations.
3.2. Dresser le tableau d?avancement de la re ?action de dissociation a` partir des données expérimentales en faisant intervenir le taux de dissociation ? de AH2. Calculer le taux de dissociation a` l?e ?quilibre ?eq dans ces conditions.
3.3. Estimer la concentration de l?ion A2 ? dans cette solution.
3.4. Expliquer qualitativement (sans calcul) comment évoluerait le taux de dissociation à l?équilibre si on ajoutait initialement une quantité plus faible d?acide ascorbique dans le même volume d?eau.
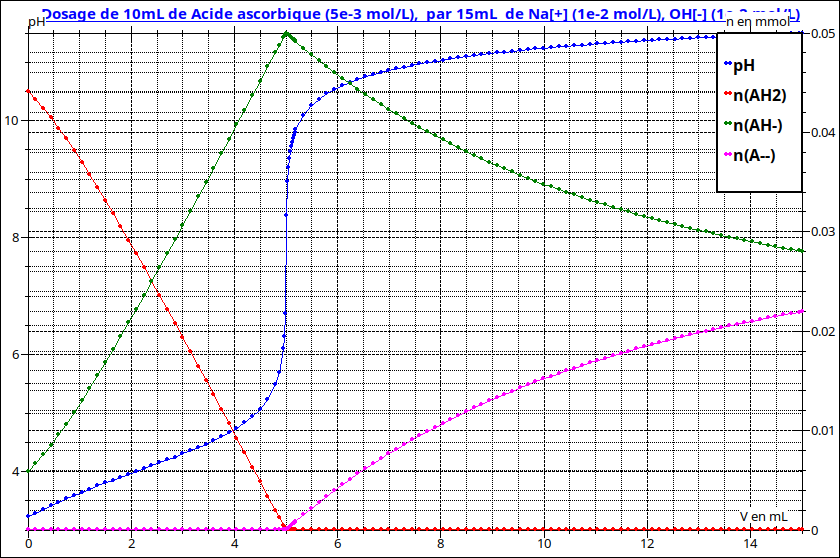
4. Une des méthodes utilisées pour doser l?acide ascorbique est de réaliser un titrage par l?hydroxyde de sodium. On réalise ici le titrage d?un prélèvement de 10,0 mL de solution d?acide ascorbique par une solution d?hydroxyde de sodium titre ?e a` Cb =1,0 × 10?2 mol L?1. La courbe du suivi pH-me ?trique en fonction du volume d?hydroxyde de sodium verse ? est donne ?e ci-dessous.
4.1. Faire un schéma détaillé du montage expérimental.
4.2. Ecrire l?équation de la réaction de titrage et calculer sa constante d?équilibre.
4.3. Déduire de la courbe fournie la concentration initiale en acide ascorbique pour ce dosage.
4.4. Exploiter la courbe de titrage pour de ?terminer une constante caractéristique de l?acide étudié.
4.5. On s?intéresse désormais au titrage de la deuxième acidité.
(a) D?apre`s l?allure de la courbe, que pouvez-vous dire de ce titrage?
(b) En utilisant la courbe estimer l?avancement de la re ?action de titrage de la se- conde acidite ? pour le volume ou` l?e ?quivalence serait attendue et conclure sur la quantitativite ? de ce titrage.
(c) à l?aide des constantes thermodynamiques dont vous disposez, montrer qu?il est possible de prévoir ce résultat.
***Titre complété => merci de préciser le chapitre ou le thème abordé la prochaine fois !***
Bonjour
qu'as-tu réussi à faire exactement ? Qu'est-ce qui te bloque ? Pose des questions précises...
j'ai répondu à la question 1 évidement avec les définition d'acide et base de Bronsted, j'ai également précisé qu'un acide qui peut libérer plusieurs ions H+ est appelé un polyacide, et qu'un acide qui possède 2 PKA est un diacide.
ensuite j'ai dis que la force de l'acide était déterminer par le PKa
comme nous avons 2 pKa, j'ai dis que pour PKA1 = 4,2 nous avions un acide fort et pour PKa2 = 7,4 nous avions un acide faible ?
ensuite pour la question 2, pour le diagramme de prédominance, j'ai dis que l'acide était prédominante quand le PH< au PKA
comme le PH de la solution est de 7,4, pour le PKA1=4,2 j'ai fais une droite avec des graduations allant jusqu'à 14. à gauche j'ai mis l'acide A-, acide ascorbique qui prédomine et à droite Ion ascorbate AH
j'ai dis que pour PKA1 = 4,2 nous avions un acide fort et pour PKa2 = 7,4 nous avions un acide faible ?
Attention : le terme "acide fort" est réservé aux acides qui réagissent de façon totale sur l'eau avec production d'ions oxonium : exemple HCl.
Concernant les acides faibles, plus le pKa est petit, plus la force de l'acide est importante mais les réactions sur l'eau restent tout de même très partielles. pKa1 nettement inférieur à pKa2 : AH2 est un acide nettement plus fort que AH-, les deux étant des acides faibles.
Domaines de prédominances :
AH2 prédominant pour pH<pKa1
AH- prédominant pour pKa1 <pH< pKa2
A2- prédominant pour pH>pKa2
Dans ces conditions, quelle est l'espèce prédominante dans l'eau ? Quelle est l'espèce prédominante dans le sérum ?
Bonjour,
@Drogba : si je supprime une image ce n'est pas pour que tu me repostes exactement la même : à l'envers et pas cadrée ...
Prière de faire plus attention la prochaine fois !
bonjour,
j'ai encore un petit problème avec ce devoir maison s'il vous plait ?
c'est pour la question 4.3 où on nous demande de déduire grâce à la courbe la concentration initiale en acide ascorbique. Il faut que je fasse la méthode des tangentes ? pour trouver VE et grâce à ça je trouverai la concentration C ?
merci.
Bonjour,
4.3. Déduire de la courbe fournie la concentration initiale en acide ascorbique pour ce dosage.
vanoise n'a pas la courbe en question, il faudrait la fournir.
Et tant qu'à faire, déroule ta réflexion pour que vanoise puisse la vérifier.
Ce sera plus efficace pour tout le monde.

La méthode consiste effectivement à obtenir le volume Ve de soude versée à l'équivalence. Pour déterminer ce volume, la méthode des tangentes est inutile. Elle est fausse sur le plan théorique dans la plupart des cas et est de toutes les façons d'une précision tout à fait illusoire. Très souvent, un simple coup d'il suffit à déterminer de façon précise le point d'inflexion de la courbe qui correspond au changement de sens de concavité de cette courbe. Sinon, le point d'équivalence correspond à un extremum de la courbe dérivée mais cette méthode précise et correcte sur le plan théorique est assez lourde à mettre en ouvre sans moyen informatique performant.
j'ai trouvé une Ve équivalent à environ 5ml
pour trouver le concentration, j'ai dis que pour un dosage, à l'équilibre n(AH2) = n(AH-)
on sait que n = C x V
donc VE x C(AH2) = V x C(AH-)
ce qui donne C(AH2) = V x C(AH-) / VE
***Image recadrée => rafraîchir la page***
As-tu compris mon précédent message ? Il devrait alors te sembler évident : Ve=5mL...
Sinon, je ne suis pas sûr que tu ais bien compris la notion de dosage.
Quand tu ajoutes la soude, tu as la réaction quasi totale d'équation :
AH2+HO- = H2O + AH-
L'équivalence est obtenue quand la quantité d'ions hydroxyde fournie par la solution de soude est égale à la quantité initialement introduite d'acide AH2. Cela conduit bien à la formule que tu as écrite mais à l'équivalence, il ne reste quasiment plus de AH2...
Pour cette question, et surtout pour les suivantes, tu pourrais peut-être lire le document suivant. Il concerne un triacide et est donc un peu plus complexe mais la recherche des réactions se fait suivant la même méthode. Tu peux laisser tomber les calculs et t'intéresser essentiellement aux parties 1 et 2. En particulier : pourquoi y a-t-il 2 sauts de pH au lieu de 3 puisqu'il s'agit d'un triacide ? Cela va t'aider à répondre aux questions posées ici, en particulier : pourquoi détecte-t-on seulement la première équivalence alors que l'acide ascorbique est un diacide ?
![]()
j'ai bien compris votre message, j'avais déjà trouvé le VE= 5mL..
je ne parlais pas de ce volume là.
j'ai dis que C(AH2) = V x C(AH-) / VE
la lettre c est traditionnellement réservée aux quantités introduites par litre (concentrations apportées) alors que la concentration réelle correspond à la formule chimique écrite entre crochets. Avec cette convention : c(AH-)=0.
La quantité d'acide ascorbique introduite par litre est Ca, l'inconnue du problème. Le volume de la solution acide utilisé pour le dosage est Va=10,0mL
La solution de soude a pour concentration apportée Cb=0,010mol/L. Le volume utilisée à l'équivalence est Ve=5,0mL
Ca.Va=Cb.Ve
Pour t'aider à terminer, j'ai rajouter à la courbe pH=f(V) les courbes représentant les variations de quantité de matière en fonction du volume V de solution de soude ajoutée.
En rouge : quantité de AH2
en vert : quantité de AH-
en rose : quantité de A2-
Cela devrait t'aider pour les dernières questions.
Bonjour, je n'ai pas compris comment faire pour les questions 3.1,3.2 et 3.3.
pour la 3.1, je ne vois pas comment exprimer le Qr en fonction des activités.
Merci d'avance pour votre aide
Bonjour, je n'ai pas compris comment faire pour les questions 3.1,3.2 et 3.3.
pour la 3.1, je ne vois pas comment exprimer le Qr en fonction des activités.
Merci d'avance pour votre aide
Bonjour,
Et si tu proposais ton expression du quotient de réaction pour que vanoise puisque échanger là-dessus ?
C'est quand même une application directe du cours ...
Pareil pour le tableau d'avancement, cela a été vu au lycée
Oui pas de soucis.
Pour la question 3.1, j'ai trouvé l'equation :
AH2(aq) + H2O(l) = AH-(aq) + H3O+(aq)
Qr= [H3O+]x[AH-]/[AH2]
C'est correct ?
Tu as « oublié » l'expression du quotient de réaction en fonction des activités...
En solution diluée, le solvant (ici l'eau) se comporte quasiment comme un corps pur :
Pour les espèces en solution diluée, AH2 par exemple :
avec c°=1mol/L : concentration de référence standard. Compte tenu de la valeur numérique de c°, il est tolérée de ne pas écrire les « c° » dans l'expression de Qr à condition que toutes les concentrations soient mesurées en mol/L et sans perdre de vue qu'un quotient de réaction est toujours une grandeur de dimension 1 (grandeur sans dimension comme on dit encore). Ton expression est donc correcte.
Merci ! Donc si j'ai bien compris, dans la question lorsqu'ils demandent le Qr en fonction des activités, je mets l'equation que vous m'avez aidé a trouver et lorsqu'ils demandent en fonction des concentrations je mets celle que je vous ai dit dans le message de 12:34.
Merci beaucoup.
Quant a la question 3.2, j'ai réalisé le tableau d'avancement suivant mais je ne sais pas si il est bon. Pourriez vous m'éclairer ?
AH2 + H20 = AH- + H3O+
Ca Exces 0 0
Ca-x x x
Ca(1-L) Ca*L Ca*L
Avec L=alpha
Pour calculer le taux de dissociation, je pense utiliser la formule suivante:
L=nproduit-dissocie/ninitial.
Mais je ne vois pas comment m'en servir
Les cinétiques de ce genre de réactions sont tellement rapides que l'on peut considérer les équilibres atteints de façon quasi instantanée. On se limite donc toujours, sauf cas très particulier clairement précisé par l'énoncé, à l'étude d'équilibre. Donc ici :
Qr=Ka1, vapeur fournie par l'énoncé puisque pKa1 est fourni. Pour être précis, il faut aussi dire que l'influence de la seconde acidité est négligeable car pKa2 est nettement plus grand que pKa1 (écart entre les deux supérieur à 4) : Ka2<<Ka1.
Donc sauf erreur de ma part, après avoir dresser mon tableau d'avancement, j'explique pourquoi ka2<<ka1.
Je dis donc que le taux de dissociation est négligeable.
En voulant être précis, je t'ai compliqué la vie... Puisque Ka1=10-4,2 et Ka2=10-11,3, on peut négliger l'influence sur le pH de la réaction :
AH- + H2O = H3O+ + A2-
On prends en compte uniquement la réaction de AH2 sur l'eau que tu as écrite en posant Qr=Ka1. Tu n'as même pas besoin de résoudre cette équation puisque le pH est fourni. Cette équation intervient cependant en 3.4
Est-ce que c'est correcte si je trouve alpha=0,13 ?
J'ai fait alpha=x/Ca
Or x=[h3o+]=10^-ph=10^3.2
Et Ca=5.10^-3
Etourderie de signe je pense mais l'idée est bonne. Attention à l'écriture : pH comme potentiel Hydrogène et non ph...