Inscription / Connexion Nouveau Sujet
Dillution
Bonjour,
Je bloque sur cette exercice j'espère que vous pourrez m'aider. Merci d'avance 
Énoncé complet:
A l'aide d'une pipette de 10 mL on prélève une solution aqueuse de chlorure d'hydrogène qu'on porte ensuite à 100 mL par addition d'eau. 50 mL de solution diluée réagissent avec 10 mL d'une solution aqueuse d'hydroxyde de potassium 1 mol/L.
Quelle est la concentration molaire de la solution aqueuse de chlorure d'hydrogène de départ?
Réponse: 2mol/L
Alors sur ma feuille j'ai d'abord découpé l'énoncé:
-> HCl : V=10 mL
-> HCl + H20 : V=100mL et C(HCl) = ?
-> H3O+ + Cl- + KOH
Vtot=60 mL
Après j'ai voulu utilisé la formule de dilution CiVi=CfVf
le problème c'est que j'arrive à avoir la concentration de KOH dans 60mL (=10mmol/L) mais je ne sais pas comment avoir la concentration en Cl- pour remonter jusqu'a la concentration de départ... 
merci 
Bonsoir,
Indication 1 :
"A l'aide d'une pipette de 10 mL on prélève une solution aqueuse de chlorure d'hydrogène qu'on porte ensuite à 100 mL par addition d'eau."
La solution ainsi obtenue ne contient (en plus des molécules d'eau) que des ions H3O+ et des ions Cl-
Indication 2 :
La solution aqueuse d'hydroxyde de potassium ne contient (en plus des molécules d'eau) que des ions HO- et des ions K+
Indication 3 :
La réaction décrite par l'énoncé est une réaction entre les ions H3O+ contenus dans la solution de chlorure d'hydrogène avec les ions HO- contenus dans la solution d'hydroxyde de potassium.
Les autres ions présents (Cl- et K+) ne participent pas à la réaction et ne doivent pas apparaitre dans l'équation bilan.
Conseil :
Pour s'entendre entre nous :
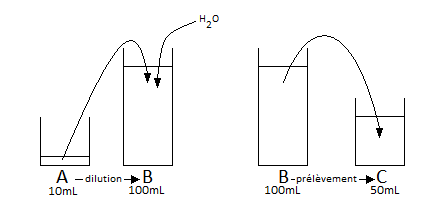
On appellera " A " la solution de chlorure d'hydrogène avant dilution.
On appellera "B " la solution de chlorure d'hydrogène après dilution.
On appellera " C " la solution obtenue par prélèvement de 50 mL de B
On appellera " D " solution aqueuse d'hydroxyde de potassium
Je te laisse cogiter ....
Merci beaucoup pour votre réponse 
Alors sans tenir compte de Cl- et de K+ je trouvais juste :
H30+ + OH- ---> 2 H2O
Mais avec H20 comme ça je ne vois pas trop quoi faire parce que H20 est toujours en excès.
Donc j'ai essayé autre chose:
A: HCl + H20 ----> H30+ + Cl-
Donc pour C on a les mêmes produits juste en quantité différente.
Donc quand on fait C + D on obtient:
H3O+ + KOH ---> K+ + 2H20
et je me retrouve au même point parce qu'on ne tient pas compte de K+ ... J'ai également le nombre de moles de KOH n=C*V= 1*0,01=0,1 mais ce n'est pas tellement ce qui m'intéresse puisque je voudrais le concentration de H3O+
Deux remarques préliminaires :
1) Bien que l'énoncé ne le précise pas, je fais l'hypothèse que :
" 50 mL de solution diluée réagissent exactement avec 10 mL d'une solution aqueuse d'hydroxyde de potassium 1 mol/L. " (Pas de réactif en excès)
2) l'équation bilan de la réaction entre les solutions C et D est bien celle que tu as écrite :
H3O+ + HO- → 2H2O
L'énoncé de cet exercice présente un processus en 3 étapes.
La première étape est une dilution : On dilue la solution A pour obtenir la solution B
Les dilutions ne modifient pas les quantités de matière présentes.
La solution B contient donc la totalité des ions H3O+ qui étaient présents dans la solution A
La deuxième étape est un prélèvement : On prélève (en volume) la moitié de la solution B pour obtenir la solution C.
On en déduit que C contient deux fois moins d'ions H3O+ que B
La troisième étape est une réaction chimique entre les ions H3O+ présents dans C avec les ions HO- présents dans D
L'équation bilan , associée à un tableau d'avancement montre que la solution C contient en ions H3O+ la même quantité de matière que la solution D en ions HO-
Bonjour,
Je rencontre un problème avec la même question.
Partons du début...
50,0 ml de la solution diluée réagissent avec 10,0 ml d'une solution aqueuse d'hydroxide de potassium 1,00mol/L. Avec la formule C1.V1=C2.V2 on trouve 0,2 moles pour C2 dans 50 ml. Logiquement, on aura 2 fois plus de moles dans 100 ml, donc 0,4 moles dans 100ml. Ces 0,4 moles viennent aussi des 10,0 mL et on aurait donc 40 moles par litres. Cependant c'est faux mais je ne comprends pas ce qu'il y a de faux à mon raisonnement.
Merci d'avance!
Désolé, mais je ne comprends pas ton raisonnement.
De toute manière plutôt que de "justifier" tes affirmations par l'adverbe " Logiquement " il te faut utiliser les lois de la physique concernant
- La réaction entre la solution diluée d'acide et la solution d'hydroxyde de sodium.
- Le prélèvement de solution diluée.
- La préparation par dilution de la solution diluée d'acide.


