Inscription / Connexion Nouveau Sujet
Diagramme Energétique LCAO
Bonjour,
A vrai dire, je n'ai vraiment rien compris au diagramme LCAO.
>> A quoi sert-il ?
>> Et surtout comment le construire ???
La 1ère question de mon exercice était de donner la composition en électrons de la couche externe de l'atome de Chlore (Cl).
Ma réponse : Cl : Z = 17
La configuration électronique est donc : 1s²2s²2p63s²3p5
La couche externe est donc 3s²3p5
Ensuite, je dois construire le diagramme énergétique LCAO de la molécule de dichlore (Cl2)
J'ai essayé un truc (Cf. le document que j'ai annexé à ce topic !)
J'ai d'abord représenté n(p) puis n(s)
Comme il s'agit du Cl2 j'ai pensé qu'il fallait faire 2 x 2 = 4 soit 4 électrons de spin opposé, 2 sur les branches haut/bas et 2 autres sur les branches Gauche/droite ... J'ai fait de même pour n(p) soit 2 x 5 = 10
A mon avis, j'ai eu beaucoup d'imagination ... Pouvez-vous m'expliquer le raisonnement svp avant que je tente d'aborder les histoires d'inversion entre les orbitales,..ect... ???
D'avant, UN GRAND MERCI !
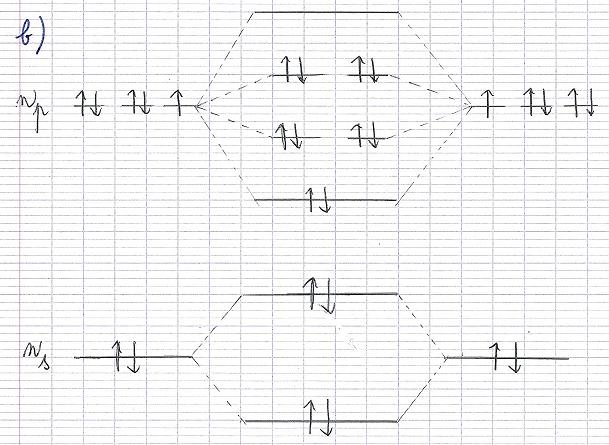
J'ai un peu avancé de mon côté ce matin...
Concernant les inversions :
Il y en a donc 3 types si j'ai bien compris (homonucléaire avec Z>7 / homonucléaire avec Z 7 / hétéronucléaire) Ici pour Cl2 par exemple, Z=17 or 17> 7 donc Cl2 est homonucléaire avec Z>7 et il n'y a donc PAS d'inversion Sigma z et Pi x - Pi y.
7 / hétéronucléaire) Ici pour Cl2 par exemple, Z=17 or 17> 7 donc Cl2 est homonucléaire avec Z>7 et il n'y a donc PAS d'inversion Sigma z et Pi x - Pi y.
Concernant l'ordre de liaison :
La formule est Ol = 1/2(ne - ne*)
MAIS Là, JE NE SAIS PAS RECONNAITRE SUR MON DIAGRAMME LES e- LIANTS ET LES e- ANTI-LIANTS !!
Une correction me marque que pour Cl2: ne = 8 et ne*= 6 ! mais pourquoi ? comment voit-on cela ?
Nombre de liaisons PI et Sigma entre les 2 atomes :
Il me semble que l'on représente Cl2 ainsi : Cl - Cl, il s'agit donc pour moi d'une liaison simple (donc liaison sigma) et il n'y aurait pas de liaison PI (VRAI ?)
Notion de molécule paramagnétique / diamagnétique :
Ici tous les e- sont appariés donc cette molécule serait diamagnétique.
Merci d'avance pour votre aide !
Salut  !
!
Le truc que tu as bricolé n'est pas si mal. Pour ma part j'ai procédé de manière analytique en effectuant des combinaisons linéaires entre deux orbitales atomiques de même énergie et de même nature. Pour simplifier j'ai supposé que les orbitales 2p et 2s n'interagissaient pas et j'obtenais un "losange" (de toute façon tu dois obtenir quelque chose de symétrique tu es d'accord? puisque pas de différences d'électronégativité)
Jusqu'à là je suis OK. Pas de  d'électronégativité = symétrie !
d'électronégativité = symétrie !
Je viens de découvrir LCAO pour la 1ère fois hier donc il y a encore des choses un peu floues...
Pour les e- liants et les e- anti-liants par exemple...
Sur des polycop, je trouve des PI, des * et des SIGMA.
Je n'ai rien mis de tout cela sur "ce que j'ai bricolé" ( ) ....
) ....
Et donc pour tout ce qui est calcul (je pense à L'ORDRE DE LIASON) je ne sais vraiment pas comment m'y prendre !
Ce sont les liaisons multiples, le doublet  agissant comme une liaison simple DC-C,
agissant comme une liaison simple DC-C,  étant plus puissant que
étant plus puissant que 
Les facteurs géométriques jouent un rôle significatif dans le degré de recouvrement. Ceci est très important pour les orbitales présentant un caractère directionnel, telles que les O p, qui donnent naissance à deux types de liaisons : l'une où les orbitales atomiques sont alignées selon l'axe internucléaire et une autre ; où les orbitales atomiques atomiques sont orientées perpendiculairement à ce même axe.Le premier recouvrement donne lieu à ce que l'on appelle des liaisons  , le second à des liaisons
, le second à des liaisons  . Toutes les liaisons simples C-C sont du type
. Toutes les liaisons simples C-C sont du type  alors que les liaisons doubles et triples ont aussi des composantes
alors que les liaisons doubles et triples ont aussi des composantes 
je te mets un petit résumé sur CLOA ... peut être que cela va t'aider .
Ces quelques remarques sont à voir avec un cours sur la CLOA …
- on va regarder quels sont les niveaux d'énergie possibles et les "probabilités de présence " ( dessin des OM ) lorsqu'on rapproche deux atomes pour former une molécule
- seuls les électrons des couches externes des atomes qu se rapprochent sont à considerer , les électrons des couches internes ne sont pas perturbés par l'approche des atomes.
- pour obtenir les OM on fait une combinaison linéaire des orbitales atomiques et lorsqu'on fait les calculs ( on ne s'occupe pas comment, c'est des maths, et on va faire confiance aux matheux !! ) on trouve que 2 OA 2s se recouvrent et vont donner 2OM sigma s et sigma s* que 2 OA pz se recouvrent pour donner sigma z et sigma z* et que 2 OA px donnent pi x et pi x* et 2OA py donnnent pi y et pi y* , l'ordre et les " dessins" de ces OM est à apprendre par coeur à mon avis ... et les dessins des OM ( avec leurs éléments de symétrie ) aussi ...
note : il est évident que l'on prend d'une façon arbitraire l'axe Oz comme axe de la molécule
- le diagramme d'OM comporte , à gauche et à droite les niveaux d'énergie des électrons externes dans les atomes éloignés et au milieu les niveaux d'énergie possibles pour les électrons externes dans les atomes liés ( rapprochés)
-on va y mettre , en respectant les règles habituelles ( 2 e- par case au maximum, on commence par les niveaux les plus bas et on occupe le maximum de cases sur un niveau donné) , l'ensemble des électrons externes des atomes qui sont rapproches ( pour la molécule O2 on a ainsi 12e- à mettre sur les niveaux tracés)
-ainsi on verra comment sont les énergies des électrons dans les atomes rapprochés ( par rapport à ce qu'ils étaient dans les atomes éloignés)et les "probabilités de présence" de ces électrons autour de la molécule par le dessin des OM .
-l'indice de liaison donne une idée de la solidité de la liaison : quand on remplit une OM liante, on gagne en stabilité ( par rapport aux atomes séparés) alors que si on remplit une OM antiliante on perd en stabilité.


