Inscription / Connexion Nouveau Sujet
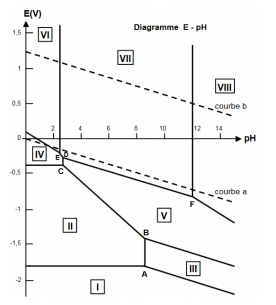
Diagramme E-pH du titane
Bonjour suis bloqué sur un exercice à propos du diagramme E-pH du Titane.
Les données et le diagramme sont joint en fin de message
Enoncé:
Le diagramme potentiel-pH simplifié du titane (donné ci-contre à 298 K) a été tracé
pour une concentration totale C de titane dissous par litre de solution, en considérant
les espèces suivantes : Ti2+(aq), Ti3+(aq), TiO2+(aq), HTiO3-(aq), Ti(s), Ti(OH)2(s), Ti(OH)3(s) et TiO(OH)2(s).
On considère qu'il y a égalité des concentrations à la frontière entre deux espèces dissoutes.
Les courbes a et b correspondent aux
limites du domaine de stabilité de l'eau.
1) Indiquer pour chacun des domaines numérotés I à VIII l'espèce existante ou prédominante. Justifier.
2) Déterminer la concentration C utilisée pour ce tracé en utilisant la frontière I/II.
3) Calculer le produit de solubilité de Ti(OH)2 qui sera noté Ks3.
4) Justifier le parallélisme des courbes délimitant les domaines I/III et III/V.
5) Montrer que le titane est instable dans l'eau. Ecrire l'équation de réaction à pH = 0.
6) Quelles sont les espèces stables dans l'eau ?
J'ai fait les questions 1 à 4 mais je bloque à partir de la 5,
Je sais que Ti(s) est instable dans l'eau car son domaine d'existence est disjoint de celui de l'eau mais je n'arrive pas à écrire la réaction qui se produit à pH=0, pouvez vous m'expliquer? J'imagine qu'il réagit avec les ions H+ mais pour former quelles espèces?
Je vous indique les domaines que j'ai attribué pour chaque numéro en question 1
VIII HTiO3-
VII TiO(OH)2
VI TiO2+
V Ti(OH)3
IV Ti3+
III Ti(OH)2
II Ti2+
I Ti (s)
Merci d'avance pour l'aide!

Une espèce d'un couple est instable en présence d'une espèce d'un autre couple si leurs domaines sont disjoints.
Le titane va s'oxyder en l'espèce stable dans l'eau à pH très acide. Ta dernière réponse est donc correcte.
Du coup il faut regarder quel espèce à pH=0 est stable dans l'eau et du coup le titane s'oxyde en celle ci?
Ok la seconde équation c'est H20+e- ->1/2H2 +OH-
Ensuite je la multiplie par 4
Et je fais la somme des deux demi équations
N'oublie pas que tu es en milieu très acide. Faire intervenir les ions hydroxyde est peu réaliste. Plus simplement :
2H+(aq)+2e- = H2(g)
Oui tu as raison donc ca donne Ti+2H+ +H2O = TiO2+ + 2H2
Pas si difficile finalement!
Merci Vanoise
Pour la question 6 j'ai mis que les espèces stables dans l'eau sont donc
TiO2+ TiO(OH)2 et HTiO3- (donc VI VII VIII) car ces espèces ont leurs domaines d'existence et de prédominance dans le même domaine que celui de l'eau.


