Inscription / Connexion Nouveau Sujet
Diagramme de Pourbaix Ni
Bonjour,
Il y a une question que je ne comprends pas dans le diagramme potentiel-pH du Nickel. On demande ce qui se passe pour l'espèce Ni2O3 quand on part de pH = 10 et qu'on diminue le pH. Moi je ne comprends pas car ça dépend du potentiel auquel on se trouve. La bonne réponse est qu'il y a passage par le point triple (en haut à gauche du domaine de Ni2O3) et dismutation à pH < 3,5. Je ne comprends pas du tout. Merci d'avance pour votre aide.
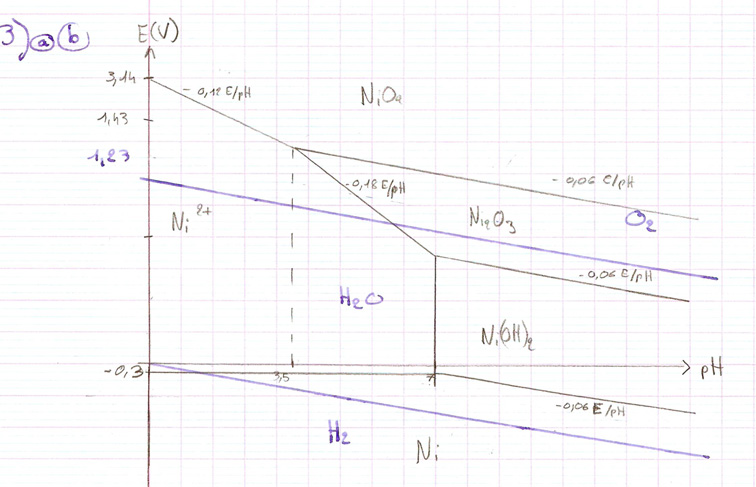
Bonsoir, en milieu très acide, Ni2O3 n'a plus de domaine d'existence. Il est donc instable par dismutation. En effet cet oxyde est à la fois l'oxydant conjugué d'un couple et le réducteur conjugué d'un autre couple...
Enfaite pour moi il se reduit en Ni2+ mais il faut un potentiel particulier pour faire aussi apparaître du NiO4, mais apparemment non. Je ne vois pas pourquoi ce n'est pas une simple réduction en Ni2+.
Moi je ne comprends pas car ça dépend du potentiel auquel on se trouve.
Cela serait vrai si on maintenait, en plongeant dans la solution une électrode de platine, un potentiel bien particulier.
Dans le cas général, le diagramme de Pourbaix permet de savoir si une espèce est stable ou non dans un certain domaine de pH et si elle est susceptible de réagir avec d'autres espèces chimiques par superposition de diagrammes. Par exemple, on peut savoir si une espèce est stable thermodynamiquement dans l'eau en superposant à ce diagramme celui de l'eau. Si le domaine d'existence ou de prédominance de cette espèce et le domaine d'existence de l'eau sont disjoints, on obtient une réaction quasi totale sur l'eau : l'espèce est instable dans l'eau.
Messages croisés : je n'ai pas répondu à ton message de 20h56.
Ni2O3 est le réducteur conjugué du couple NiO/Ni2O3 et l'oxydant conjugué du couple Ni2O3/Ni2+
Ni203 va donc se dismuter en Ni2+ et Ni0.
Ni203 est instable dans l'eau en milieu très acide (voir mon message précédent ; il va donc ensuite se réduire en Ni2+
Mais NiO4 est instable dans l'eau, or quand on diminue le pH on est dans l'eau...
Donc si je comprends bien :
1) Ni2O3 est un ampholyte acido-basique il va donc naturellement se dismuter en Ni2+ et NiO4, à moins d'impose un potentiel constant.
2) De la même manière si on a du Ni(OH)2 et qu'on diminue le pH il va se dismuter en Ni2+ et Ni2O3.
3) et si on a du Ni2+ et qu'on augmente le pH ?
Désolé je comprends bien c'est diagramme mais pas ces variations de pH.
Dernier message posté trop vite. C'est le NiO créé par dismutation qui est instable dans l'eau et qui va être réduit en Ni2+.
Il est facile de faire varier le pH soit en ajoutant de la soude pour l'augmenter, soit de l'acide chlorhydrique pour le diminuer.
Attention à ne pas confondre oxydoréduction, qui correspond à une variation de nombre d'oxydation et une simple réaction de précipitation ou de dissolution de précipité dhydroxyde de nickel (II).


