Inscription / Connexion Nouveau Sujet
Diagramme de phase
Bonjour,
Pourriez-vous m'expliquer ce qu'il se passe quand on comprime de la glace avec l'aide du diagramme de phase s'il vous plait ?
Bonsoir;
La courbe d'équilibre liquide - solide P = f(T) ayant une pente négative dans le cas de l'équilibre eau liquide glace, il est théoriquement possible d'obtenir une fusion de la glace par compression isotherme. Expérimentalement, les choses sont compliquées car la courbe est en fait presque verticale : pour en juger imagine une augmentation de la température de celle du point triple (273,16K) à 0°C (273,15K) : cette baisse de température de un centième de kelvin correspond à une augmentation de pression de 611Pa à 1,013.105Pa .Dans ce domaine de températures, la courbe d'équilibre est assimilable à une droite de coefficient directeur voisin de 107Pa/K...
C'est bien ardu ... sans autres précisions.
Comprimer ... certes mais à quelle température et à parir de quelle pression et jusque quelles pression et température ... et en passant par quel "chemin" (en température et pression) ?
Le diagramme de phase de l'eau est plus compliqué que celui généralement fourni
Le voici :
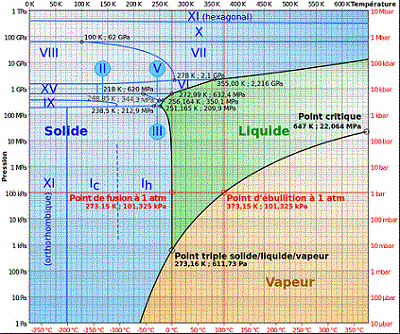
Les différentes structures cristallines que prend la glace (notées Ih , III, ... XI) sont décrites sur ce lien : ![]()
Il faut donc, sur le diagramme, partir de conditions connues (pression et température) et suivre un chemin connu pour évoluer vers les conditions finales (qui doivent être précisées aussi).
On peut alors suivre toutes les évolutions de structure de la glace sur le diagramme.
Il se peut même que, sous certaines conditions, en comprimant la glace, on repasse par l'état liquide, avant de repasser enfin vers l'état solide (par exemple en comprimant à température négative mais pas trop fort (par exemple -20°C), arriver vers 200 MPa, la glace repasse à l'état liquide, avant de redevenir solide à plus haute pression ...
Sauf distraction. 
Le diagramme de phase de l'eau est plus compliqué que celui généralement fourni
Effectivement : le diagramme habituellement étudié se limite à des pressions à peine supérieures à la pression critique (Pc
 221bar, tc
221bar, tc 374°C).
374°C).
Attention : le diagramme ci-dessus utilise une échelle logarithmique pour les pressions, d'où des allures inhabituelles des courbes d'équilibres qui semblent en contradiction avec la loi de Clapeyron...


