Inscription / Connexion Nouveau Sujet
diagramme d'orbitale moléculaire.
Bonjour,
on m'a demandé d'étudier b2 et je n'ai pas trouvé donc j'ai cherché sur le net ou il y avait ca :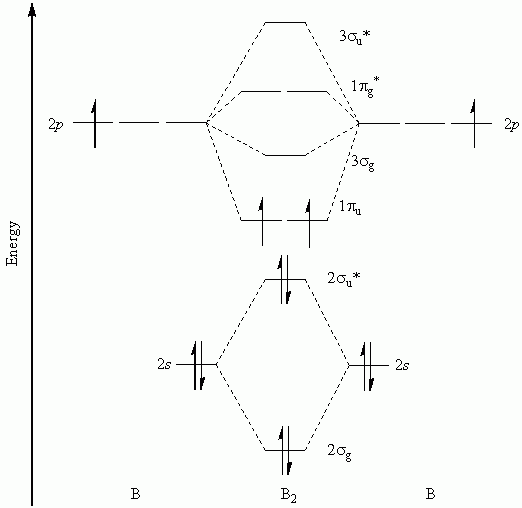
Mais je ne comprends pas deux choses :
Comment on sait que les 2 liaisons pi ont une énergie inférieure que celle de la sigma dans la couche 2p ?
Quand je regarde les Ol, je trouve 0 pour sigma et 1 pour pi, pourquoi on a pas 1 pour sigma et 2 pour pi comme le voudrait la représentation de lewis ?
Merci d'avance.
***Image insérée sur le serveur et recadrée --> tu peux faire de même en utilisant le bouton Img juste en-dessous du cadre où tu écris***
Re,
merci pour ta réponse, je crois avoir réponse à ma deuxième question mais pour la première, je ne vois toujours pas.
bonsoir
Tu as la réponse aux paragraphes 3.6 et 3.7 du document fourni mais cela n'est pas très détaillé... Je me demande s'il n'est pas plus sage d'admettre le résultat en le considérant comme justifié par l'ensemble de ses conséquences expérimentales...
Hum je n'ais pas compris mais bon ce n'est pas très très très grave.
Je crois que je les ferais de telle sorte que j'ai un Ol pi et un Ol sigma satisfaisant un peu comme ce qu'on fait avec l'hybridation d'ailleurs ^^ (il me semble) .
[sup][sup]1[/sup][/sup]
Compte tenu de la "géométrie" des orbitales moléculaires  et
et  , il est assez intuitif (je ne parle pas de démonstration...) d'imaginer que, en cas d'occupations simultanées de l'O.M.
, il est assez intuitif (je ne parle pas de démonstration...) d'imaginer que, en cas d'occupations simultanées de l'O.M.  et de l'O.M. 3
et de l'O.M. 3 issues des orbitales atomiques 2p, le doublet d'électrons occupant l'O.M. 2
issues des orbitales atomiques 2p, le doublet d'électrons occupant l'O.M. 2 * exerce une répulsion plus forte sur les électrons de l'O.M. 3
* exerce une répulsion plus forte sur les électrons de l'O.M. 3 que sur les électrons de l'O.M.
que sur les électrons de l'O.M.  , ce qui provoque l'inversion des niveaux d'énergie.
, ce qui provoque l'inversion des niveaux d'énergie.
P.S. : j'ai utilisé les notations de ton premier message.


