Inscription / Connexion Nouveau Sujet
Diagramme
Bonsoir,
Un exo me pose des difficultés.
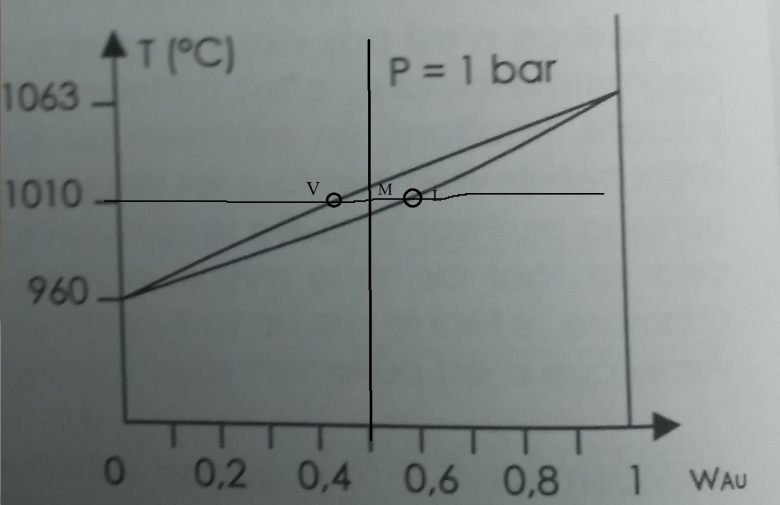
On donne le diagramme binaire isobare à 1 bar du système Au-Ag (voir en dessous), où x est la fraction massique en or. On mélange 10g d'argent et 10g d'or, et on chauffe le tout pour porter le mélange à 1010°C. Quelle est alors la fraction molaire de l'argent dans les différentes phases du mélange ?
Données : M(Ag)=108 g.mol-1 et M(Au)=197 g.mol-1
J'ai plusieurs questions :
1. Le point M est associé à la fraction molaire : x=n(Au)/[n(Au)+n(Ag)]. Est-ce correct ?
2. Je pense utiliser le théorème des moments chimiques : nv=LM/LV. Avec M, L et V les points placés sur le graphique (le graphique que j'avais initialement était vierge). Ensuite, quoi faire ?
3. J'ai juste vu que l'abscisse du point V c'est 0,45 et l'abscisse du point L c'est 0,59. Mais physiquement, à quoi correspondent ces valeurs ? Je sais que c'est des fractions massiques, mais fractions massiques de quoi ? Et comment les utiliser dans le théorème des moments chimiques ?
4. Une fois qu'on a nv avec le théorème des moments, comment puis-je trouver la fraction molaire de l'argent dans les différentes phases du mélange ?
5. Et si je ne suis pas du tout dans la bonne direction, pourriez-vous me dire quelle est la méthode pour cet exercice ? Car je panique totalement quand je vois des diagrammes binaires…
En vous remerciant, bonne soirée.
Bonjour
w représente la fraction massique de l'or : masse d'or sur (masse margent + masse or)
Le théorème des moments est une bonne idée
Mais attendez, je ne me serais pas complètement trompé par hasard ?
Car j'ai mis des points liquide/vapeur, j'ai appliqué le théorème des moments pour la vapeur, alors que je crois qu'on es dans le cas solide/liquide ?
Comment modifier en conséquence ?
Merci beaucoup.
Le point que tu as noté V correspond en fait au liquide et le point que tu as noté L correspond en fait au solide. En revanche, ton énoncé, tel que tu l'as copié, inverse la convention habituelle de notation concernant les fractions molaires et massiques. Traditionnellement, la lettre x est associée aux fractions molaires et la lettre w aux fractions massiques. A lire ta première phrase : ce serait le contraire. Une erreur de copie de ta part ou une inversion de la part de l'énoncé ?
En tout cas : mélanger des masses d'argent et d'or égales conduit à une fraction massique de 0,5. Tes points sont donc correctement placés seulement si, comme je le pense, w désigne la fraction massique. Une fois obtenu les fractions massiques, on peut toujours obtenir les fractions molaires connaissant les masses molaires de Ag et Au.
Je viens de vérifier, j'ai bien recopié l'énoncé. Mais par contre je pense que vous avez raison, il devrait y avoir écrit w au lieu de x dans l'énoncé.
Voici donc ce que j'ai fait :
(à partir des abscisses des points S, M et L.
D'où :
Mais j'obtiens un nombre négatif ?!
Alors où est l'erreur que j'ai faite ?
Comment rectifier ?
Puisque l'axe des abscisse désigne la fraction massique, le théorème des moments chimiques conduit à :
Il faut donc faire le raisonnement avec les masses. Un fois le calcul avec les masses et les fractions massiques terminé, tu peux calculer les fractions molaires connaissant les masses molaires.
Ah oui, vous avez raison !
Voici comment j'ai modifié :
(m correspond bien à la masse totale, soit 1 gramme ?).
D'où :
Ces calculs sont-ils corrects ?
Mais comment obtenir à partir de ces données là la fraction molaire de l'argent dans les différentes phases du mélange ?
Selon la première phrase de l'énoncé, la masse totale vaut 20g ; sinon : le raisonnement me semble correct.
fraction molaire de l'argent dans la phase solide :
Même raisonnement pour la phase liquide.
OK.
Et donc ws et wl ça se dit comment "en français" ?
Pas sûr d'avoir compris à quoi cela correspond "physiquement"...
Fraction massique d'un composé dans la phase solide : ws.
Fraction massique d'un composé dans la phase liquide : wl.


