Inscription / Connexion Nouveau Sujet
Déterminer les états de valence d'un atome
Bonjour,
Dans le cadre des révisions d'un examen, je m'entraîne sur des annales mais une question me pose problème:
A l'aide du formalisme des cases quantiques, écrire la configuration électronique de l'atome de soufre dans ses différents états de valence.
On me donne le numéro atomique du soufre (16), je sais écrire sa configuration électronique, j'ai même la correction (valence 2, 4 et 6), mais pas moyen de savoir comment on trouve ça. Quelqu'un peut-il m'éclairer svp?
Merci d'avance !
Voici une explication sous forme de schéma : en rouge : les électrons de la couche de valence de l'atome de soufre. En vert : les électrons venant d'autres atomes pour créer les doublets de liaison. L'idée est de faire intervenir le niveau 3d initialement vide.
Pose d'autres questions si cela ne te parait pas clair.
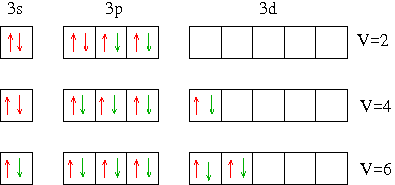
Si j'ai bien compris on déplace les électrons qui sont par paire jusqu'à ce qu'il n'y ait plus QUE des électrons célibataires?
Et je ne comprend pas pourquoi on est passé directement de la couche p à la couche d, alors que normalement ça devrait être la couche s.
En tout cas merci déjà pour votre réponse.
Si j'ai bien compris on déplace les électrons qui sont par paire jusqu'à ce qu'il n'y ait plus QUE des électrons célibataires?
Je dirais plutôt : on déplace des électrons sur des orbitales d'énergies voisines de façon à obtenir un nombre d'électrons célibataires de l'atome de soufre égal à la valence.
je ne comprend pas pourquoi on est passé directement de la couche p à la couche d,
Ta remarque est des plus logique : dans l'atome seul, le niveau 4s est d'énergie plus basse que le niveau 3d. On ne peut comprendre qu'en tenant compte de la notion d'hybridation des orbitales atomiques : on montre en mécanique quantique qu'une combinaison linéaire de fonctions d'onde vérifiant l'équation de Schrödinger est aussi une fonction d'onde. Il est ainsi possible de combiner les orbitales atomiques que tu connais pour obtenir de nouvelles orbitales atomiques dites "hybrides" dont la géométrie est en accord avec l'expérience. Ainsi pour le soufre , la valence 2 correspond à une hybridation sp3 : à partir de l'O.A. 3s et des 3 O.A. 3p on obtient 4 O.A. sp3 occupée, pour 2 d'entre elles par un doublet de liaison, pour les 2 autres par un doublet non liant. C'est le cas par exemple pour la molécule H2S dont la géométrie est très proche de celle de H2O.
La valence 4 correspond à une hybridation sp3d : 1 doublet non liant, 4 doublets de liaisons
La valence 6 correspond à une hybridation sp3d2 : 6 doublets de liaisons.
Comme tu l'as fait remarquer, le fait de "déplacer" des électrons du soufre sur les O.A. d'énergies plus élevées rend l'atome moins stable mais la structure formé du soufre et des autres atomes qui lui sont liés est stable une fois les liaisons covalentes établies.
Pourquoi ces hybridations là plutôt que d'autres envisageables ? Simplement parce qu'elles sont en accord avec l'expérience !
Deux liens qui pourront t'aider :


