Inscription / Connexion Nouveau Sujet
Déterminer la fin d'une réaction chimique
Bonsoir à tous,
je rencontre un petit problème concernant un exercice que j'ai à faire (je suis en 3ème).
Voilà, le problème concerne la réaction entre une solution de sulfate de cuivre et une solution d'hydroxyde de sodium.
J'ai ce tableau : (cf pièce jointe)
On me demande ensuite de déterminer à partir de quelle volume la réaction chimique est terminée (avec un calcul), et de dire à quelle masse de précipité ça correspond. Je suis perdue ... Instinctivement et avec le graphique, j'ai bien compris que le volume doit être compris entre 25mL et 38,4mL, et que le précipité doit être enter 12,5 et 19,2g. Mais je ne vois pas le calcul que je peux faire ...
Merci d'avance de votre aide.
Cordialement et bonne soirée. 
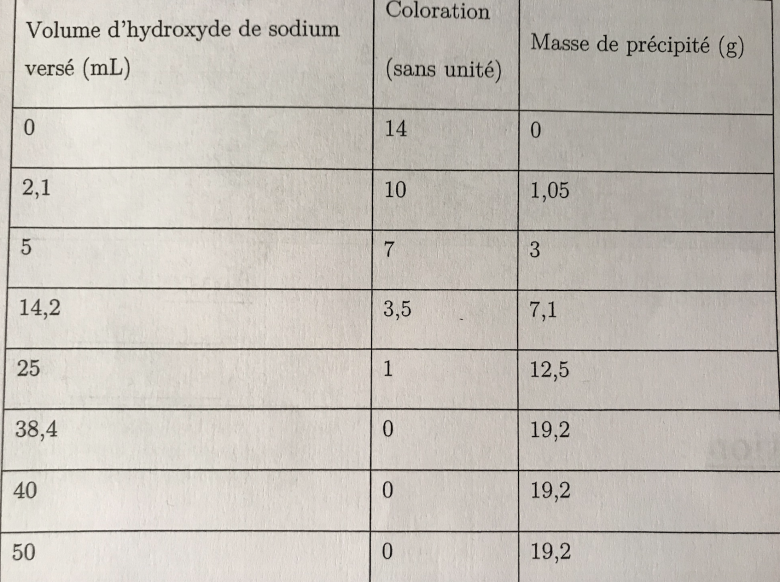
Coucou! Pour commencer, je te conseille de tracer un graphique de la masse du précipité (en g) en fonction du volume d'hydroxyde de sodium versé. Le début de ta courbe est une fonction linéaire. Puis après tu as une fonction constante. Ainsi lorsque ta réaction est terminé, les courbes de la fonction linéaire et constante se croise. Tu résous donc une petite équation. Normalement ta fonction linéaire a pour coefficient 0,5 et ta fonction constante est de 19,2
Tu résous: 0,5x=19,2 donc x=19,2/0,5=38,4ml d'hydroxyde de sodium versé en fin de réaction.


