Inscription / Connexion Nouveau Sujet
Détermination de la valence d'un atome à partir de Lewis
Bonjour.
Dans une série d'exercices, il m'est demandé de déterminer par calcul le nombre d'oxydation ainsi que la valence de l'atome central d'une molécule dont j'ai préalablement réalisé la représentation de Lewis. Comment puis-je déterminer ces deux valeurs avec pour seules données ma représentation (sur base des datives, de l'électronégativité, des charges formelles...) ?
Par exemple, comment calculer le NO et la valence de l'atome d'azote dans cette molécule ?
Bonne journée.
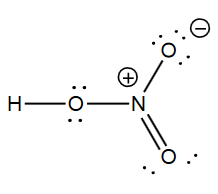
Bonsoir
HNO3 étant une molécule, la somme algébrique des n.o. est nulle.
H n'appartient ni à H2 ni à un hydrure donc : n.o.(H)=+I ;
O n'appartient ni à O2 ni à un peroxyde donc : n.o.(O)=-II
On peut donc écrire :
n.o.(N)+1+3*(-2)=0
Je te laisse terminer.
Ah oui d'accord. Cette technique me paraît bien plus abordable que celle vue en cours, tout du moins je la comprends 
Dans mes souvenirs, pour la valence, on comptait les liaisons ioniques/covalentes (+1) et puis les liaisons datives (+2) mais je ne suis plus du tout certain de cette opération.
Pour le NO, je pense qu'on comptait le nombre de liaisons de l'atome central avec un atome plus électronégatif que lui (+1) ou moins électronégatif (-1). Ce ne sont que de vagues souvenirs. En tout cas cette nouvelle technique me semble bien plus logique et efficace. Merci beaucoup !
Il existe une méthode générale de détermination du n.o. en tenant compte de la structure.
Le n.o. est la charge fictive qu'aurait l'élément en supposant que toute les liaisons se coupent en tenant compte de leur état de polarisation. Je prends l'exemple "piégeant" du peroxyde d'hydrogène (eau oxygénée) : H - O - O - H
Chaque liaison H-O est polarisée car O est plus électronégatif que H. A la rupture fictive de la liaison, H deviendrait H+ et O deviendrait O-. La liaison O-O n'est pas polarisée car existant entre deux atomes identiques. A la rupture de cette liaison, chaque atome O récupérerait son électron mis en commun dans la liaison. La rupture de cette liaison ne produit pas de charge sur l'élément O.
Au final :
n.o.(H)=+I
n.o.(O)=-I et non pas -II comme le plus souvent.


