Inscription / Connexion Nouveau Sujet
Deshydratation pièce CaCl2
Bien le bonsoir à tous. Je bloque sur un exercice de thermodynamique chimique et aurais besoin de vos lumières. Voici l'énoncé :
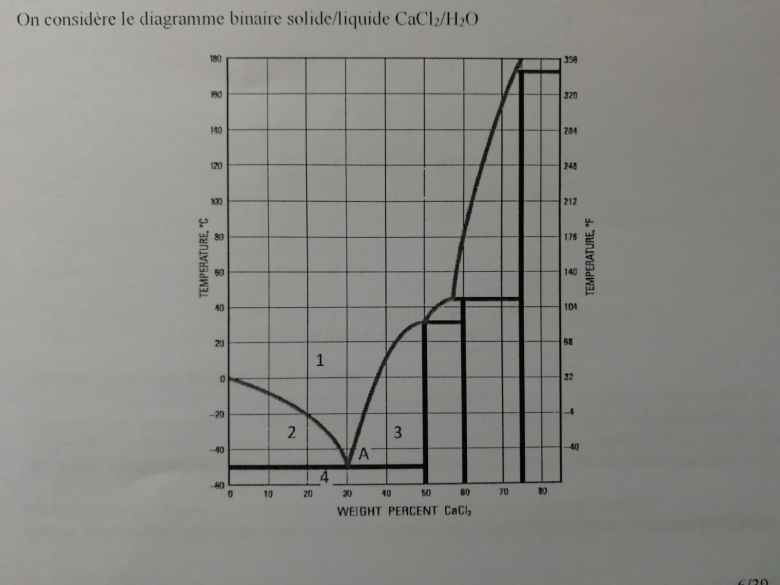
Diagramme binaire solide/liquide en fraction massique de CaCl2/H2O.
1. Il y a trois composés définis, dont CaCl2, 2H2O et CaCl2, 6H2O. Identifier le troisième.
2. Indentifier les phases présentes dans 1, 2 ,3, 4. Que représente le point A ?
3. Tracer une courbe d'analyse thermique pour le refroidissement isobare d'un mélange de composition 20% en CaCl2 en masse.
4. On veut deshydrater un pièce de volume 30m. La concentration en eau est de 0,6 mol/m3. On met 750g du composé défini le plus à droite sur le diagramme. Qu'a-t-on à l'état final ? On pourra supposer qu'il n'y a plus d'eau dans la pièce.
Données : Masses molaires de Ca, H, O, Cl.
Les trois première questions ne m'ont pas posé de problème, pour les composés définis on a de gauche à droite CaCl2, 6H2O , CaCl2, 4H2O et CaCl2, 2H2O.
Seulement, je ne vois pas bien comment mener la question 4. Auriez vous des pistes ?
Merci d'avance !
Bonjour
Connaissant le volume de la pièce et la concentration en eau, tu peux calculer la masse totale d'eau. Ayant la masse de CaCl2 et supposant que toute l'eau présente dans l'air à disparu, tu peux déterminer w : la fraction massique de CaCl2 introduite. Reste ensuite l'interprétation du diagramme.
Bonjour merci pour votre reponse. Il y a donc 1g d'eau au total (m=n*c/M= 30*0.6/18). Ce qui me turlupine c'est le composé défini ! Vu qu'il contient de l'eau ( CaCl2, 2H2O) est-ce que je dois la compter dans la masse d'eau totale ?
Étourderie j'espère : l'eau contenue dans l'air représente 18mol soit une masse de 18*18=324g. Il te faut maintenant connaître aussi la masse d'eau apportée par les 750g de composé défini ainsi que la masse de CaCl2. C'est uniquement après ces calculs que tu pourras calculer w.
Oups, effectivement j'ai voulu aller un peu trop vite !
Donc on a mair = 324g masse de l'eau dans l'air.
Pour le composé défini (CD) on détermine sa quantité de matière on déduit la quantité de matière d'eau dans le CD nCD = 10,02mol d'où la masse d'eau dans le CD mCD = 10,6*18 = 180,3 g
On a alors ~ 50%
Ce qui correspond à peu près aux proportions du premier composé défini. Pour conclure j'imagine que je dois déterminer la masse de composé défini (CaCl2, 6H2O ) formé ?
Je constate après coup une erreur de frappe on a mCD = 10,02*18. Cela ne change pas significativement la valeur de la fraction massique de chlorure de calcium.
Globalement d'accord avec toi ; je suis arrivé à w=52,7% donc très légèrement à droite de la frontière d'existence de (CaCl2,6H20) qui est à 50,7%. Peut-on considérer, à température ambiante, que l'état final correspond uniquement à (CaCl2,6H20) ou faut-il tenir compte de la masse très faible de (CaCl2,4H20) ? Je te laisse juge...
Merci beaucoup ! Je discuterai de cela avec mon professeur. C'est un sujet d'oral, une discussion avec l'examinateur(trice) n'est donc pas exclue !!
Merci encore !
D'accord ! Quoi qu'il en soit, à température ambiante, cela te donne à l'état final : 750+324=1074g de solide.
Ré-Bonsoir! En fait, si on a pas exactement 6 fois plus d'eau que de chlorure de calcium on ne peut pas former exclusivement le CD Cacl2, 6H20 donc je ne retombera jamais sur 1024g si jamais je fait l'approximation des 50% (j'ai essayé je tombe sur 1117g.
Donc je pense qu'il faut plutôt rester sur 52.7% afin de ne pas tomber sur un résultat aberrant.
Je ne vois pas de difficulté à faire le calcul précis en utilisant le théorème des moments chimiques.
C'est ce que j'ai fait ! J'obtiens une masse de 784g pour le CD Cacl2, 6H2O et donc 290 g pour Cacl2, 4H2O
La valeur de w étant très proche de la frontière gauche du domaine d'existence de (CaCl2,2H2O), la proportion massique de ce composé est très importante. Personnellement, pour une masse totale de solide de 2014g, j'obtiens 852g de (CaCl2,2H2O) et 172g de (CaCl2,4H2O).


