Inscription / Connexion Nouveau Sujet
Dégénérescence des orbitales d
Bonsoir,
je ne comprends pas cette notion de levée de dégénérescence des orbitales d quand un métal de transition s'entoure de ligands (configuration à bas spin). Quelles sont les différences entre un état à haut spin et un état à bas spin ? En fonction de l'état, l'atome ne fait pas le même nombre de liaisons ?
Pourriez vous m'expliquer svp ?
Merci
Bonsoir,
il y a plusieurs questions que tu soulèves, je vais tenter d'y répondre :
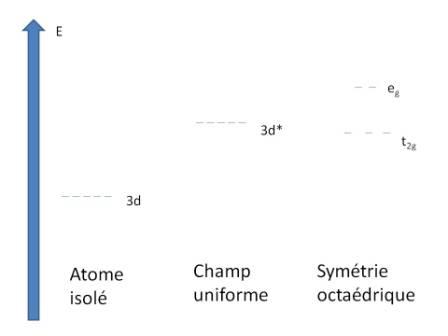
Tout d'abord imagine-toi un atome métallique complètement isolé. Celui-ci comporte alors 5 orbitales 3d, qui sont a priori au même niveau énergétique. Ce sont donc des orbitales dégénérées.
A partir de là, imagine-toi ce même atome baignant dans un champ électrique uniforme : ce champ interagit de la même manière avec les 5 orbitales, celles-ci sont déstabilisées de manière équivalente. Les orbitales 3d sont donc toujours dégénérées mais sont à un niveau plus énergétique que pour l'atome isolé.
En bref, un champ électrique déstabilise les orbitales d.
Maintenant imagine que le métal forme un complexe à 6 ligands (identiques pour simplifier). Le complexe adopte une géométrie octaédrique. Tu peux assimiler un ligand à un dipôle électrique donc créant un champ électrique local. Contrairement à tout à l'heure, le champ n'est pas uniforme mais plus intense au niveau des axes : les orbitales d ne sont pas identiquement déstabilisées. Si tu dessines les 5 orbitales d et que tu identifies celles qui sont le plus localisées au niveau des axes, tu te rendras compte que 2 d'entre elles sont plus déstabilisées que les 3 autres car plus localisées au niveau des axes. 2 orbitales (eg) sont plus hautes en énergie que les 3 autres (t2g), il y a alors levée de dégénérescence.
J'ai fait le raisonnement pour une géométrie octaédrique, tu peux le refaire pour une géométrie tétraédrique et tu trouveras une autre disposition des énergies pour les orbitales.
En ce qui concerne l'état à haut spin et l'état à bas spin :
On a vu qu'on obtient un complexe comportant 5 orbitales (3 t2g et 2 eg, plus hautes en énergie).
Il faut maintenant y placer les électrons provenant des orbitales d du métal.
Pour les trois premiers c'est facile, ils sont placés sur les 3 orbitales les moins énergétiques. S'il y en a plus, ça se complique. Pourquoi ?
On sait que le complexe adoptera la conformation qui sera la moins énergétique. Imaginons qu'il faille placer 4 électrons.
Soit on place le 4e électron sur une orbitale t2g, soit sur une eg.
Dans le 1er cas il faut apparier 2 électrons car les 3 orbitales t2g sont déjà occupées. C'est la configuration à bas spin car le spin total n'est que de 1/2 + 1/2 = 1. Seulement apparier 2 électrons est coûteux en énergie (les électrons se repoussent plus au sein d'une même orbitale). L'énergie totale est alors 4xE(t2g) + 1xE(appariement)
Dans le 2e cas les 4 électrons sont célibataires. C'est la configuration a haut spin, S = 4 x 1/2 = 2.
L'énergie totale dans cette configuration est 3xE(t2g) + E(eg)
Pour savoir si le complexe sera dans l'état à haut spin ou à bas spin il faut comparer ces 2 énergies, sachant que l'état de plus faible énergie sera gagnant !
J'espère que c'est assez clair.
Merci d'avoir pris le temps de m'expliquer 
Malheureusement je comprends plus à partir du moment où le métal forme un ligand...
J'ai dessiné le métal avec ses orbitales (désolée si c'est faux, je sais pas vraiment comment représenter des orbitales), mais je vois pas lesquelles sont plus ou moins déstabilisées.
Ouh-lo, non ce n'est pas ça du tout.
Une recherche google t'aidera en ce qui concerne les orbitales d.
Mais je te conseille quand-même de faire de grosses révisions d'atomistique avant de te lancer dans la chimie inorganique, sinon tu risques d'avoir de gros soucis.
Essaie déjà de faire cet exercice d'identifier les orbitales qui seront les moins déstabilisées et les plus déstabilisées par l'arrivée des ligands.
Fais-moi signe si tu rencontres un problème.
D'accord.
C'est avec ce genre d'images que je dois visualiser ?
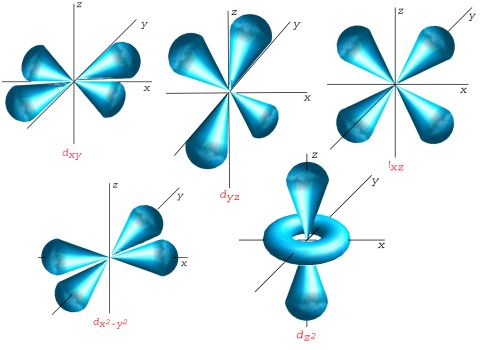
Parce que je connais la représentation avec les cases quantiques mais avec ça je vois pas non plus quelles orbitales sont déstabilisées.
Pourtant j'ai révisé mon atomistique... J'arrive à répondre en général aux questions (qui ne sont pas non plus très poussées).
J'arrive à répondre en général aux questions (qui ne sont pas non plus très poussées).
Excuse-moi mais j'arrive pas à répondre à ta question.. moi j'aurais dit que le ligand, puisque c'est le même, il déstabilise les orbitales de la même manière.
Ce sont bien les représentations des 5 orbitales d.
Si le complexe à former est octaédrique, il y a 6 ligands qui arrivent :
- de par les x positifs.
- de par les x négatifs.
- de par les y positifs.
- de par les y négatifs.
- de par les z positifs.
- de par les z négatifs.
Les orbitales les plus déstabilisées sont donc celles qui sont le plus proches des axes.
Sur l'image tu vois bien que les 2 dernières orbitales (dx2-y2 et dz2) sont localisées autour des axes. Ce sont les orbitales eg.
Alors que les 3 premières sont les plus éloignées des axes (elles ne les touchent qu'à l'origine). Ce sont les orbitales t2g.
En clair la géométrie des orbitales d du métal n'est pas du tout octaédrique. Pour forcer la formation d'un complexe octaédrique les énergies de ces orbitales sont modifiées de manière différente.
J'espère que ça aura éclairci ce point mais je ne peux que te conseiller de te replonger dans l'atomistique et le concept d'orbitales atomiques. A quel niveau d'études es-tu ?
Si tu as une question précise n'hésite pas à la poser, j'essaierai d'y répondre.
J'ai bien tout relu et j'ai compris !
Merci beaucoup pour ton aide 
(Je suis en première année de médecine, on a 2h d'atomistique.)


