Inscription / Connexion Nouveau Sujet
Conformère et rotation dans l'espace
Bonsoir désolé encore moi, mais j'ai vraiment un doute sur une notion :
je voulais savoir si une molécule était considérée comme identique à un de ses conformères ? Même si par définition, ce sont les mêmes, juste une rotation autour d'une liaison sigma, est ce qu'on peut passer d'un conformère à un autre en affirmant quand même que c'est toujours la même molécule ? Je ne sais pas si c'est clair
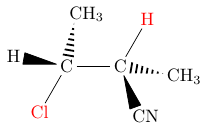
Exemple :
Donc ici, j'ai la molécule de haut qui est censée être égale à celle du bas
Mais pour moi, ce sont des conformères et non exactement la "même" molécule
Je m'explique :
Je vois que les substituants du Carbone de haut, on fait une seule rotation vers l'avant (vers nous) pour que finalement :
le Cl qui était à l'avant, se retrouve dans le plan
le CH3 qui était dans le plan se retrouve en arrière
donc ce carbone a fait une rotation vers nous
mais pour le deuxième carbone du bas, pour moi :
a fait une rotation vers l'arrière :
le CN qui était à l'arrière est passé devant
le CH3 qui était dans le plan est passé à l'arrière
J'espère que vous voyez ce que je veux dire 
Donc pour moi ce sont des conformères, mais le problème c'est que pour moi c'est de la "triche" :
en effet, si j'explique le contexte de cet exercice, je devais faire une élimination E2 :
Or celle ci ne se fait que pour un halogène (ici Cl) et un H Antiparallèle, et donc au sein de la molécule de haut (qui est la molécule de base) , je vois que le Cl et le H du carbone bas sont syn parallèle
et donc finalement on ne peut a priori pas faire de E2
Mais ce n'est seulement qu'en faisant une rotation qu'on fait en sorte que le H soit anti par rapport au Cl donc je ne comprends pas
cela veut dire qu'on peut "bidouiller" notre molécule pour que cela nous arrange
Par conséquent, si on me demande si le produit de la réaction de cette E2 est un alcène Z ou E , je peux très bien bidouiller la molécule de départ pour faire en sorte qu'on ait soit le Z soit le E à la fin non ?
Je pars peut être trop loin mais je ne comprends pas si on peut passer par un rotamère pour résoudre un quelconque exercice ?
Merci beaucouppp d'avance 
Bonjour
juste une rotation autour d'une liaison sigma, est ce qu'on peut passer d'un conformère à un autre en affirmant quand même que c'est toujours la même molécule ?
En présence d'une liaison sigma, tu as une infinité de conformères possibles puisque la rotation autour de l'axe de liaison sigma est libre. A température ambiante, on peut imaginer une rapide rotation autour de l'axe de cette liaison de sorte qu'on obtient à l'échelle macroscopique un seul produit dont les propriétés sont les propriétés moyennes des divers conformères.
cela veut dire qu'on peut "bidouiller" notre molécule pour que cela nous arrange
Une réaction E2 nécessite la présence d'une base forte. Et c'est la présence de cette base qui oriente la rotation autour de l'axe de la liaison sigma de façon à obtenir le conformère le plus favorable à la réaction.
BOnsoir merci
Ah d'accord je comprends mieux
Donc finalement, si dans le cas d'une E2, et que la molécule de base n'est pas censée avoir la possibilité de réaliser cette réaction, dois je vérifier si ses conformères sont capables comme dans le cas de mon message principale ?
Mais finalement, si je suis à priori libre de réaliser quelques rotations sur ma molécule, comme saurais-je quelle isomérie Z ou E obtiendrais-je à la fin d'une E2 ?
Et pour étendre le problème, dans le cas de configuration R S, je peux à priori faire des rotations autour de ma liaison, et donc la rotation R et S changerait même si l'ordre de priorité reste la même non ?
"L'attaque" de la base sur l'atome H d'un C, favorise la conformation où l'atome X, juste avant d'être éliminé, est le plus loin possible de cet atome H : voir schémas du document joint à partir de la page 42 : ![]()
Il n'y a donc pas d'ambiguïté sur l'isomère obtenu Z ou E.
Et pour étendre le problème, dans le cas de configuration R S, je peux à priori faire des rotations autour de ma liaison, et donc la rotation R et S changerait même si l'ordre de priorité reste la même non ?
"et donc la rotation R et S changerait" : je ne comprends pas bien cette phrase... La libre rotation autour de l'axe de la liaison
 entre deux C* ne modifie pas le caractère R ou S de chaque C* et les propriétés (y compris éventuellement optique) de la molécule résultent de la moyenne des propriétés des différents conformères.
entre deux C* ne modifie pas le caractère R ou S de chaque C* et les propriétés (y compris éventuellement optique) de la molécule résultent de la moyenne des propriétés des différents conformères.Ah oui enfaite oubliez ce que j'ai dit sur R et S
Donc finalement si je résume je suis bien libre de faire des rotations autour de ma molécule
et donc les conformères ont bien les mêmes propriétés
D'accord merci beaucoup 
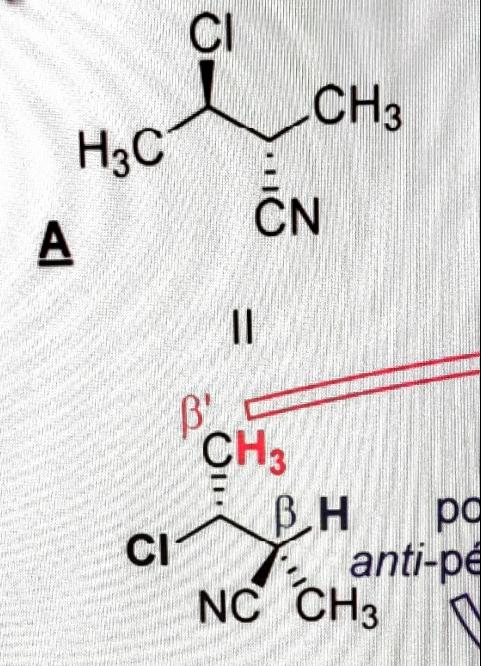
bonsoir je me permets de revenir sur la figure de la molécule :
j'ai refait l'exercice mais comme dit auparavant, il faut que le Cl et le H soient en anti pour pouvoir faire une elimination E2.
Mais ce que j'ai fait :
J'ai juste faire une rotation sur le carbone portant le CN d'une demi rotation (donc le CN passe à l'avant) et c'est tout (je n'ai pas touché au carbone alpha)
Avec ceci, j'obtiens un H et un Cl anti
pourtant j'obtiens du coup un alcène Z à la fin
Or c'est un alcène E qu'on devait avoir
et pour se faire, le corrigé a également fait une rotation sur le carbone alpha
Donc je ne comprends pas comment peut on savoir quelle rotation doit on faire et sur quel carbone ?
car quelle utilité de toucher au carbone alpha si juste en touchant le carbone voisin, on arrive à obtenir un H et Cl anti ?
Merci d'avance et bonne année
Pour être bien sûr de ne pas faire d'erreur, j'ai ressorti une vielle boîte de modèles moléculaires. Pour ton exemple, E2 conduit bien à l'isomère E. Tu peux représenter ta molécule de départ en perspective dans la conformation juste avant la rupture des deux liaisons ?
D'accord, j'ai enfaite redessiner mes deux molécules comme vous me l'avez suggerez , et effectivement, en essayant de bien voir dans l'espace, je me rends comptes que cela fait bien un E (même sans toucher au carbone alpha )
J'ai un peu de mal a faire des rotations aha
Merci
Histoire de bien vérifier que nous sommes maintenant d'accord, voici une représentation en perspective de la molécule juste avant la rupture des deux liaisons.
Mince je n'ai pas fait ceci 
J'ai pris ma molécule de départ
j'ai fait une rotation sur le carbone béta :
au départ :
CN en arrière
CH3 plan
H en avant
après rotation :
CN plan
CH3 avant
H en arrière
et par cette configuration, j'ai du coup le Cl (du Calpha) en avant et le H (du C béta) en arrière et donc anti
Ne peut on pas faire ceci ?
Pourquoi pas ? J'ai trouvé plus simple de représenter, en rouge et dans le plan vertical, les atomes concernés par l'élimination . On visualise bien ainsi que cette conformation anti les place les plus éloignés possible l'un de l'autre.


