Inscription / Connexion Nouveau Sujet
Concentration d'une espèce titré lors d'un double titrage
Bonjour,
Mon exercice provient de la partie D de ce sujet ![]() Titrage 2
Titrage 2
Il y a une double réaction mise en jeu lorsque l'on titre par la soude :
concentration C1
concentration C2
On donne le volume contenant le tout égale à 20mL avec Ve1 et Ve2 les deux volumes à l'équivalence et Ve1 = 10mL < Ve2 = 25mL.
Quand on calcule la concentration à l'équivalence de l'acide chlorhydrique (dosé en premier), peut-on faire
ou doit-on tenir compte que dans Ve1 = 10mL de soude, il n'y aura pas 10mL qui vont réagir avec les ions oxonium puisqu'une partie de la soude réagit avec les ions aluminium III ?
J'ai du mal à voir bien ce qu'est la concentration à l'équivalence. J'aurais tendance à dire que comme la première équation utilise un seul ion hydroxyde et la deuxième en utilise 3, que dans Ve1 = 10mL, 7,5mL de soude vont pour la deuxième et 2,5mL pour la première. Et ma deuxième suggestion serait 5mL pour chaque.
Je vous remercie d'avance.
Bonjour
ou doit-on tenir compte que dans Ve1 = 10mL de soude, il n'y aura pas 10mL qui vont réagir avec les ions oxonium puisqu'une partie de la soude réagit avec les ions aluminium III ?
Tant que [Al3+][HO-]3<Ks soit :
la réaction de précipitation n'existe pas : la courbe correspond au dosage par la soude de l'acide fort seul.
Le point anguleux correspond au démarrage de la réaction de précipitation. La mesure de l'ordonnée de ce point et la formule ci-dessus permet donc de trouver pKs.
La courbe en pointillé est quasiment verticale entre le pH de début de précipitation et pH=7 valeur correspondant à la fin du titrage de l'acide fort. On peut donc, en excellente approximation, considérer que le dosage de l'acide fort est achevé lorsque débute celui des ions aluminium...
On part toujours de cette relation avec le Ks lorsque l'on a deux équations que l'on dose en même temps dont une qui va former un solide/précipité ?
Sinon je ne vois toujours pas bien comment on sait que c'est l'acide fort d'abord, on a ni pKs ni C2 qui sont des inconnues. La question D)31) étant "Montrer que les ions sont dosés en premier".
En fait je ne visualise pas bien ce que fait la soude, pour moi elle coexiste avec les valeurs et quand le pH a atteint une certaine valeur (on se fie au diagramme EpH) les ions ne sont plus stables et se transforment en
, et de même pour les oxonium.
Montrer que les ions
Le plus souvent, on traite cette question en comparant les deux constantes d'équilibre. Si le rapport de ces constantes est très supérieur à 1 (en pratique, de l'ordre de 104 ou plus), on peut considérer que la réaction ayant la plus grande constante d'équilibre se produit la première, les deux réactions pouvant alors être considérées comme successives et indépendantes. N'ayant pas ici la valeur de pKs, on peut simplement remarquer que pour pH < 3,9, la courbe pH = f(v) est exactement la même que celle étudiée précédemment, lorsque les ions aluminium n'étaient pas présents, la réaction se produisant entre l'acide et la soude... Jusqu'à pH = 3,9 c'est donc uniquement la réaction entre l'acide et la soude qui se produit.
En fait je ne visualise pas bien ce que fait la soude, pour moi elle coexiste avec les valeurs
La soude disparaît par réaction au fur et à mesure qu'elle est introduite tant que la seconde équivalence n'est pas atteinte. Seulement ensuite, elle coexiste avec les autres espèces. Je ne sais pas si cela va t'aider : je te joins la courbe pH = f(v) à laquelle se superposent :
1 - la courbe d'évolution de [Al3+] en rouge, échelle à droite : cette concentration diminue lentement entre v =0 et v=10mL par simple effet de dilution puis diminue rapidement entre v = 10mL et v = 25mL par réaction chimique pour devenir quasi nulle après la seconde équivalence.
2- la courbe en vert représentant l'évolution de la quantité de Al(OH)3(solide). Elle est nulle jusqu'à v = 10mL ; elle augmente jusqu'à v = 25mL puis reste fixe.
3- La courbe en bleu d'évolution de [HO-] ; cette concentration reste négligeable avant la seconde équivalence.
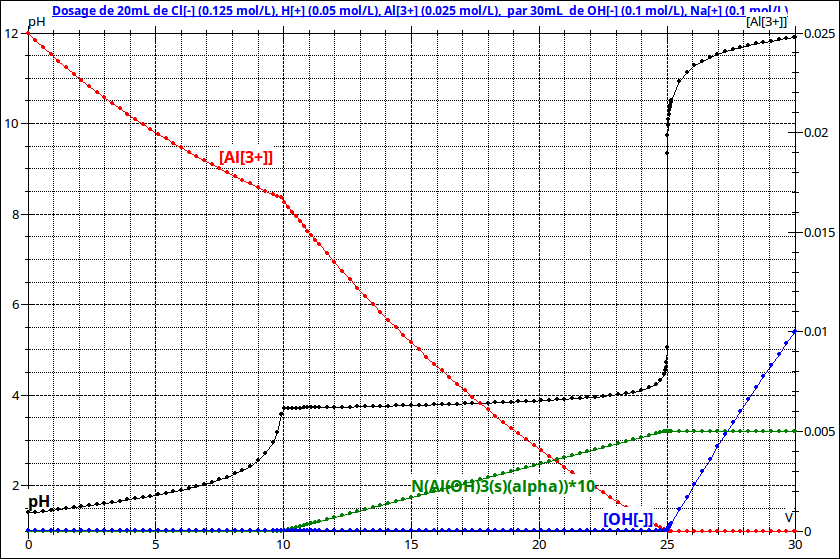
Je vois, donc si on le peut, on compare les K° des deux réactions et si par quotient l'un est 10^4 fois supérieur, on en conclut que c'est la première.
Mais d'où sortez-vous [Al3+][HO-]^3<Ks parce qu'en soit Ks=[Al3+][HO-]^3
Pourquoi cela serait donc inférieur ?
Votre graphique m'aide pas mal, il manque la courbe des H+ qui je suppose baisse tout comme Al3+ et c'est ce qui fait monter le pH.
Cependant si jusqu'à 10mL la réaction est uniquement le dosage de l'acide fort, pourquoi la concentration en Al3+ baisse-t-elle aussi ? D'après ce que vous m'avez dit plus haut je considérais que la réaction de formation du précipité ne démarrait pas avant Veq=10mL.
Bonjour
Mais d'où sortez-vous [Al3+][HO-]^3<Ks parce qu'en soit Ks=[Al3+][HO-]^3
Il faut que tu revois ton cours sur la différence entre quotient de réaction et constante d'équilibre. Dans le cas particulier des précipitations, l'égalité Ks=[Al3+][HO-]^3 n'est vérifiée qu'à l'équilibre, c'est à dire lorsque le précipité existe, quelle qu'en soit sa quantité. Si le précipité n'existe pas , l'équilibre n'existe pas, on obtient : [Al3+][HO-]^3<Ks avec [Al3+]=c2 puisque les ions Al3+ n'ont pas encore commencé à réagir. Revois bien ton cours sur les solutions saturées et insaturées.
Cependant si jusqu'à 10mL la réaction est uniquement le dosage de l'acide fort, pourquoi la concentration en Al3+ baisse-t-elle aussi ?
J'ai donnée l'explication dans mon message précédent, de façon peu détaillée il est vrai.
Pour v<Ve1, la quantité C2Vo de Al3+ reste fixe mais le volume de la solution augmente : il vaut (Vo + v), la concentration en ions aluminium :
diminue donc en fonction de v malgré l'absence de réaction, par simple effet de dilution.
Ma réponse précédente à propos de la dilution me fait penser que mon message du 08-03-16 à 15:47 concernant l'inégalité vérifiée par le pH en absence de précipité n'est valide qu'au début du titrage, en v = 0. Pour v> 0, il faut tenir compte de la dilution. Je repose le calcul pour v >0 . Tant que le précipité n'existe pas :
Sachant que l'apparition du précipité a lieu pour v=Ve1=10mL et pH=3,9 avec c2 = 0,025mol/L et Vo=20mL, on obtient :
ce qui conduit à une valeur de pKs voisine de 32...
En effet, l'apparition du précipité correspond au cas limite où la condition d'existence de celui-ci est atteinte, la quantité de précipité formée étant négligeable devant les autres quantités.
Je vous remercie pour vos précisions, j'avais en effet conclu trop vite pour la définition du Ks, vu que l'on n'est pas à l'équilibre dès le début.
Je comprends bien aussi pour la diminution de sur le schéma, et je dois dire que sans le schéma je ne me serai jamais posé la question, au moins si je tombe sur un schéma au concours ca ne m'étonnera pas autant.
Je vois aussi pour la fin, mais je me demande encore quelque chose. Vous en concluez qu'à pH=3,9, on est à l'équilibre, je suppose que votre explication provient de cette phrase : "l'apparition du précipité correspond au cas limite où la condition d'existence de celui-ci est atteinte"
Vous en arrivez à cette conclusion parce que à l'équilibre et qu'avant Ve=10mL ce produit valait 0 ?
Ce que tu viens d'écrire montre que tu as bien compris, sauf la dernière phrase qui traduit une incompréhension de ta part concernant la différence entre constante d'équilibre K et quotient de réaction Q (ou Qr). Revois le cours à ce sujet et en particulier la signification physique des situations correspondant à :
Qr < K
Qr = K
Qr > K.
Le document que je t'ai fourni explique cela de façon détaillée mais la démonstration que j'utilise n'est peut-être pas à ton programme...
De plus, j'obtiens : .
Comment obtenez-vous ?
Enfin, pour Qr < K la réaction évolue dans le sens direct, Qr = K l'équilibre et Qr > K sens indirect, donc lorsque le précipité se forme on évolue dans le sens direct, en l'occurence ici ce n'est pas une dissolution mais une précipitation donc l'équilibre est K=1/Ks.
Est-ce suffisant pour comprendre pourquoi on est à l'équilibre à pH=3,9 ou je dois revoir mon cours ?
Tu as oublié de tenir compte du fait que 3 ions HO- réagissent avec un ion Al3+ !
Est-ce suffisant pour comprendre pourquoi on est à l'équilibre à pH=3,9 ou je dois revoir mon cours ?
Cela permet surtout de comprendre pourquoi l'équilibre correspond à Ks=[Al3+][HO-]3 et pourquoi l'inégalité [Al3+][HO-]3<Ks correspond à l'absence de précipité.
En effet, c'est une grosse erreur en plus. Je vous remercie.
Sinon l'équilibre correspond à 1/Ks et non à Ks.
Avec notre équation, on a :
Donc entraine bien
et donc une l'équation évolue dans le sens indirect ce qui ne produit pas le précipité. (l'équation n'évolue pas d'ailleurs je pense puisqu'on n'a pas de solide)
Par contre pour elle évolue dans le sens direct et donc formation d'un précipité, donc juste avant la formation d'un précipité on est à l'équilibre, soit à pH=3,9. Mon raisonnement est correct ?
Les choses sont un peu plus compliquées quand un solide intervient dans la réaction ...
La définition rigoureuse du quotient de réaction fait intervenir les activités :
Si on écrit la réaction dans le sens de la dissolution :
La constante thermodynamique de cette réaction se définit à partir de l'enthalpie libre standard de la réaction :
Ks est une grandeur constante ici car la température est fixe. L'activité d'un ion en solution est numériquement égale à sa concentration mesurée en mol/L. L'activité d'un solide vaut 1 si le solide est présent, quelle qu'en soit la quantité. S'il est absent, l'activité n'est pas définie, ce qui complique un peu la situation.
Pour savoir si le précipité est présent à l'équilibre, on imagine une situation initiale où le solide existe en quantité infinitésimale :
donc : .
Trois cas sont envisageables :
Qri = Ks : la situation initiale est une situation d'équilibre : présence de précipité avec : .
Qri > Ks : évolution spontanée dans le sens de la dissolution, ce qui entraîne l'augmentation de la quantité de précipité et la diminution des concentrations en ions, donc une diminution de Qr jusqu'à ce que l'équilibre soit atteint avec encore : .
Qri < Ks : évolution spontanée dans le sens de la disparition du précipité. La quantité initiale de celui-ci étant infinitésimale, sa disparition est totale sans augmentation appréciable des concentrations en ions. On aboutit donc à une absence de précipité et une solution (dite insaturée) telle que . Donc finalement :
Je vous remercie pour cette précision très complète. Je ne pense pas que les activités soient au programme, dans le cours on a défini cette relation (loi d'action des messages) mais après on a dit :
pour mélange idéal de gaz parfaits
pour solutions aqueuses diluées
et on a dit que pour un système hétérogène comportant des solides
pour toutes les phases condensées dans les expressions de et de
Puis vous m'avez montré qu'on pouvait résoudre l'exercice sans les activités. En tous cas ca fait plaisir pour la culture générale puis plus tard quand je le rencontrerai je saurai mieux ce que c'est !
Je me suis entrainé sur un autre exo de chimie (qui lui est corrigé), mais je ne trouve pas mon erreur à un endroit, puis ma valeur concorde bien avec la suite de l'exercice. Pourtant c'est un bête calcul de densité... 
C'est ici pour le sujet ![]() et ici pour la correction
et ici pour la correction ![]() qui a été proposée par quelqu'un.
qui a été proposée par quelqu'un.
La question est : "
II.4- Déterminer la masse minimale de chlorure d'hydrogène dissous dans 1L de solution commerciale."
avec comme infos : "Sur une bouteille d'acide commercial figure l'indication suivante : solution à P = 23 % en chlorure d'hydrogène minimum. Cette indication signifie que 100 g de solution commerciale ont été obtenus par dissolution d'au moins 23 g de chlorure d'hydrogène. P est donc un pourcentage massique en HCl(g) dissous dans la solution commerciale.
On souhaite vérifier la teneur exacte en chlorure d'hydrogène dissous de cette solution commerciale.
La densité de la solution commerciale est d = 1,15."
Du coup j'ai fait 1L de solution pèse 1150g. (car d:1,15)
donc vu que dans 100g de solution il y a dissolution d'au moins 23g, j'en déduis qu'il y a dissolution d'au moins 264,5g dans 1L.
Et la correction utilise cette formule :
et il en déduit
Bonjour
Le corrigé dont tu fournis la référence me semble faux. Le calcul qu'il fait suppose que P = 23% signifie que l'on mélange 23g d'HCl avec 100g d'eau. Or, l'énoncé me semble clair : il y a 23g d'HCl dans 100g de solution. Ton calcul me semble correct.
Ca me rassure, je vous remercie.
Je trouve également le tableau d'avancement proposé dans la correction un peu léger.
J'ai regardé votre tableau d'avancement dans vos fiches ici ![]()
et vous mettez une ligne "constituants", une ligne "quantités introduites", et une ligne "quantité présentes", pour être rigoureux en concours mettre ces 3 lignes suffisent ou faut-il en mettre plus ? (ou moins ?)
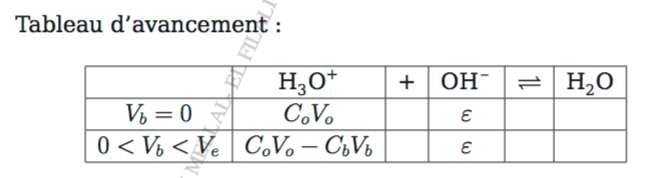
Dans mon document, j'ai rempli une succession de tableaux d'avancement simples : cela est rapide avec la fonction "copier-coller" des traitements de texte. Un jour de concours, où tu devras tracer les traits du tableau "à la règle", tu gagneras du temps en remplissant un seul tableau comportant autant de lignes que de situations physiquement différentes. Pour le problème précédent, il faut :
une première ligne pour Vb=0mL
une seconde pour 0<Vb<Ve1
une troisième pour Vb=Ve1
une quatrième pour Ve1<Vb<Ve2
une cinquième pour Vb=Ve2
une sixième pour Vb>Ve2
Je vous remercie.
Je vais noter ca sur mes fiches alors. Et pour le tableau de la correction proposée, ce n'est pas bizarre de mettre l'avancement dans OH- ? Puisqu'on dose avec OH- donc à Vb=0 et à 0 < Vb < Ve j'aurais tendance à dire que c'est 0 aussi.
Le tableau proposé par le corrigé "oublie" la première ligne concernant les quantités introduites. En fait, cette ligne pourrait remplacer la ligne Vb = 0 qui n'apporte pas grand'chose à la compréhension. La seconde ligne correspondrait alors à :
0 Vb<Ve1.
Vb<Ve1.
Puisque la réaction est quasi totale, pour Vb <Ve1, on peut considérer que l'avancement est égal à Cb.Vb , ce qui conduit à la ligne écrite dans le corrigé...
La suite du problème concerne la méthode de Gran que j'explique à la fin de mon document...
Si sa première ligne correspond aux quantités introduites, dans ce cas oui on peut mettre l'avancement dans la colonne de OH- mais la deuxième ligne reste fausse non, il faudrait mettre un environ 0 comme dans vos tableaux d'avancement ? Ou alors il faudrait écrire CbVb - avancement sur la ligne ?
Puisque pour Vb < Ve, la réaction étant totale, on n'a quasi pas de soude puisque toute celle introduite réagit.
Et on peut mettre l'avancement à toutes les lignes pour H2O, par contre.
Je vais aller lire votre explication sur la méthode de Gran pour être sûr d'avoir compris.
Je viens de saisir ce que tu ne comprends pas dans le tableau fourni par le corrigé ! Le symbole  utilisé (epsilon) signifie que la quantité de HO- est quasi nulle comme tu l'as compris ! Tu sembles confondre
utilisé (epsilon) signifie que la quantité de HO- est quasi nulle comme tu l'as compris ! Tu sembles confondre  avec le symbole
avec le symbole (Xi) habituellement utilisé pour désigner l'avancement !
Ah oui c'est exactement ca ! Je vous remercie beaucoup !
Vous avez toujours les réponses à mes questions, je suis désolé de vous en poser pleins. 
Toujours dans la même annale il y a une question simple mais là c'est une question pour la rigueur, on a en données les Delta f G à 298K
On a la réaction et on doit calculer Delta r G 298K.
Ils utilisent pareil que pour la loi de Hess, donc signe positif pour les Delta f G des produits et signe négatif pour les Delta f G des réactifs. Or dans mon cours la loi de Hess qui dit que l'équation d'une réaction quelconque est la combinaison linéaire des réactions de formation des espèces utilisent les Delta f H pour calculer Delta r H.
Ca marche pour l'enthalpie libre et l'entropie aussi du coup, ce n'est pas limité qu'à l'enthalpie ?
Une grandeur standard de réaction ( rX° dans le cas général), fait intervenir une différence entre les grandeurs molaires standard des produits et les grandeurs molaires standard des réactifs (en tenant compte bien sûr des coefficients stchiométriques de la réaction). Puisqu'il s'agit d'une différence, on peut choisir arbitrairement l'état correspondant à une grandeur molaire standard nulle à condition que ce choix soit le même pour les produits et les réactifs (analogie avec le niveau d'énergie potentielle de pesanteur nul en mécanique).
rX° dans le cas général), fait intervenir une différence entre les grandeurs molaires standard des produits et les grandeurs molaires standard des réactifs (en tenant compte bien sûr des coefficients stchiométriques de la réaction). Puisqu'il s'agit d'une différence, on peut choisir arbitrairement l'état correspondant à une grandeur molaire standard nulle à condition que ce choix soit le même pour les produits et les réactifs (analogie avec le niveau d'énergie potentielle de pesanteur nul en mécanique).
Si on choisit comme état de référence de grandeur standard nulle, l'état de corps simple, la grandeurs standard de réaction fait intervenir les grandeurs molaires standard de formation. Cela est presque toujours le cas pour  rH°, c'est assez fréquemment le cas pour
rH°, c'est assez fréquemment le cas pour  rG°, c'est rarement le cas pour
rG°, c'est rarement le cas pour  rS° : dans ce dernier cas, on choisit souvent comme état de référence de grandeur standard nulle le corps considéré (qu'il soit simple ou composé) à la température de 0K (zéro kelvin).
rS° : dans ce dernier cas, on choisit souvent comme état de référence de grandeur standard nulle le corps considéré (qu'il soit simple ou composé) à la température de 0K (zéro kelvin).
Je vois, je vous remercie pour votre explication ! J'ai lu aussi la page wikipédia ![]() pour bien comprendre ce vocabulaire complexe.
pour bien comprendre ce vocabulaire complexe.
En fait comme on ne peut pas mesurer l'enthalpie, on a des valeurs de référence qui valent 0 (les Delta H f des corps simples) et pour par exemple on obtient le Delta H f du CO2 en regardant l'énergie nécessaire pour la formation du CO2. Est-ce juste ?
Quand on calcule les Delta H r standard, on fait donc des combinaisons linéaires des Delta H f standard, ou des enthalpies molaires standard. Mais alors l'enthalpie molaire standard est égale à l'enthalpie standard de formation, ou sa référence est juste différente ? Quel serait sa référence dans ce cas ?
Une autre question sur vos fiches. J'ai bien compris la méthode de Gram, et j'ai bien réussi les questions du sujet, mais j'ai une question par rapport à la constante d'acidité. Lors de la détermination de Ve2, vous poser la Ka comme défini ci-dessous sur l'image.
Or cette valeur est le Ka uniquement pour les concentrations à l'équilibre non ? Pourtant vous ne précisez pas qu'on est à l'équilibre.
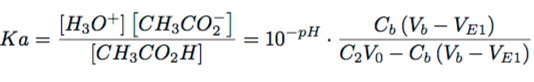
Bonjour
Mais alors l'enthalpie molaire standard est égale à l'enthalpie standard de formation
C'est cela : dans cette convention, l'enthalpie standard de tous les corps simples est nulle et l'enthalpie standard des corps composés est égale à leur enthalpie standard de formation.
Pourtant vous ne précisez pas qu'on est à l'équilibre.
C'est vrai que je ne le précise pas à chaque équation... Ta remarque justifiée m'a fait rajouter une phrase au début de mon fichier pour expliquer que , les cinétiques de ces réactions étant extrêmement rapides,toutes les situations étudiées sont des situations d'équilibre, même si, pour alléger l'écriture, on n'écrit pas l'indice "e" pour chaque concentration.
Bonjour,
Je vous remercie pour votre réponse.
C'est vrai que je ne le précise pas à chaque équation... Ta remarque justifiée m'a fait rajouter une phrase au début de mon fichier pour expliquer que , les cinétiques de ces réactions étant extrêmement rapides,toutes les situations étudiées sont des situations d'équilibre, même si, pour alléger l'écriture, on n'écrit pas l'indice "e" pour chaque concentration.
Comment peut-on savoir que la cinétique de réaction est rapide ? Parce que si on le sait c'est un argument de taille, on peut utiliser tous les Ka/Ks etc.
Tu as raison : les choses ne sont pas toujours précisées clairement dans les énoncés... Disons simplement que, sauf si justement le problème consiste à étudier une cinétique chimique, l'hypothèse peut être faite.
Etudier une cinétique chimique, c'est par exemple avoir les valeurs des Ka, et voir comment évoluent les concentrations vers cette stabilité en fonction du temps ?
Parce que dans le double titrage, vous m'avez montré qu'il y avait précipité ou pas précipité en fonction du Ks, or c'est un titrage et non une étude de cinétique chimique, je me trompe ?
Etudier une cinétique chimique, c'est par exemple avoir les valeurs des Ka, et voir comment évoluent les concentrations vers cette stabilité en fonction du temps ?
Cela pourrait effectivement être cela mais la quasi totalité des réactions acide-base sont extrêmement rapides : on se contente d'étudier les états d'équilibres.
Par exemple, lorsque tu fais un titrage acide base : tu laisses couler à l'aide de la burette le volume désiré de solution titrante dans la solution à titrer : tu agites quelques secondes le temps de rendre le mélange bien homogène ; cette très courte durée est suffisante pour que la mesure de pH que tu fais alors corresponde à un état d'équilibre.
Bonsoir,
Je vois. Je vous remercie pour votre réponse.
Du coup, à moins que cela soit précisé ou clair dans le sujet, on peut quasi toujours faire l'hypothèse qu'on est à l'équilibre ?


