Inscription / Connexion Nouveau Sujet
Complexe et pH
Bonjour,
Lors d'un TP (un dosage d'une solution avec 10mL de (Al2SO4 + H2SO4) et 100mL d'oxalate de sodium par de la soude), je dois déterminer la concentration de C2O42- de la solution d'oxalate de sodium grâce au Kd et aux pH mesurés.
Avez-vous des idées ?
(je connais la concentration de Al3+)
+ Savez-vous comment je peux savoir si une solution de Al2SO4 de pH=7 est possible ?
Bonjour
+ Savez-vous comment je peux savoir si une solution de Al2SO4 de pH=7 est possible ?
Tout dépend de la concentration en ions aluminium ! sachant que l'hydroxyde d'aluminium à un pKs égal =à 36,3, tu devrait être capable de répondre à la question.
Pour le reste : tu fournis trop peu d'indications pour une aide efficace. A mon avis, l'acide sulfurique est initialement présent pour empêcher la précipitation des ions aluminium sous forme d'hydroxyde d'aluminium. En présence d'un excès (je suppose !) d'ions oxalate, on peut envisager, vue la valeur du pKd du complexe et vue la valeur du pKs de l'oxalate d'aluminium, que avant l'ajout de soude, les ions aluminium sont soit complexés sous forme d'ions trioxalatoaluminate(III) soit précipités sous forme l'oxalate d'aluminium, les ions aluminium(III) étant ultraminoritaires...
On peut donc envisager trois dosage successifs et indépendants :
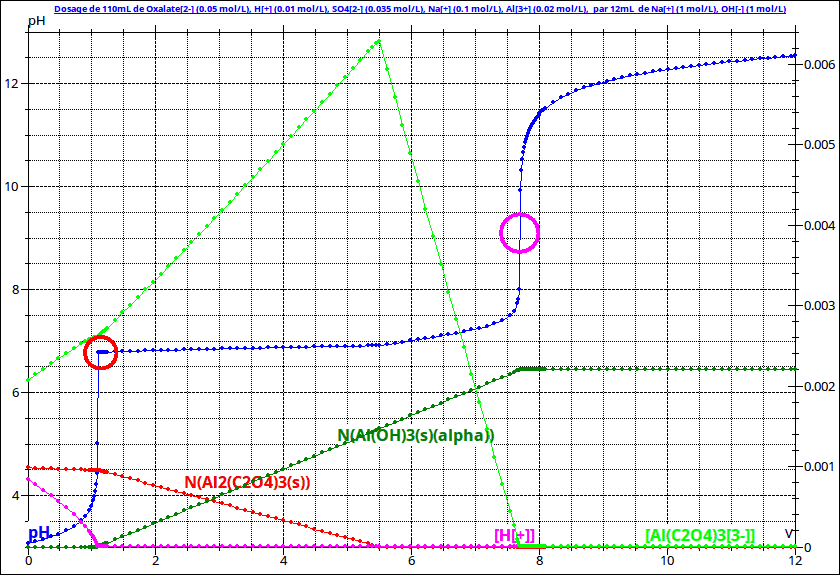
1° : le dosage par la soude de l'excès d'acide sulfurique que l'on peut assimiler ici à un diacide fort. Ve1 un peu supérieur à 1mL pour la simulation ci-dessous.
2° : le dosage du précipité d'oxalate d'aluminium avec formation du complexe ;
Cela correspond à la partie quasi horizontale de la courbe du pH ; Ve2 voisin de 5,5mL pour la simulation.
3° le dosage par la soude des ions complexes selon l'équation :
Ve3 voisin de 7,5mL pour la simulation.
Cela n'est pas très simple et pourtant j'ai pas mal simplifié en négligeant la présence des complexes ono et di oxalatoaluminate.
Tout cela, sous réserve comme déjà dit. Si cela se trouve : l'acide sulfurique n'est pas introduit en excès ! ???
Merci,
pour la solution de pH=7, j'ai trouvé une concentration en Al3+ de 0.08 mol/l et de H+ de 0.2 mol/l.
pour le reste, j'ai 2 sauts de ph dont j'avais déduit un dosage acide/base pour le 1er puis la formation de Al(OH)3 (ce que tu as l'air de me confirmer) et la formation de Al(OH)4 -. (à confirmer)
Pour la solution de ph=7, faut-il faire
0.08*(10^-7)^2 = 8.10^-23 > 10^-36.3 donc il y a formation de précipité, donc non ce n'est pas possible ?
D'accord avec ton dernier message. Pour une concentration apportée en ions aluminium, on évite la précipitation pour pH inférieur à environ 2,2 d'où l'ajout, je suppose d'acide sulfurique.
Sinon : il te faudrait retrouver le pKd du complexe Al(OH)4- mais il est très peu probable qu'il se forme ici, sauf solution de soude titrante très concentrée.
alors à quoi correspond le 2e saut ?
Je pense que tu veux parler de celui correspondant à Ve3
 7,5mL sur ma simulation.
7,5mL sur ma simulation.
Entre Ve1 et Ve3, les ions HO- ajoutés disparaissent de façon quasi totale au fur et à mesure par les réactions 2 puis 3, ce qui explique pourquoi le pH augmente très peu entre Ve1 et Ve3.
Dès que la réaction 3 est terminée, les ions HO- que l'on continue à ajouter reste en solution sans réagir ; pour cette raison, la concentration [HO-] augmente assez rapidement, d'où l'augmentation importante de pH. N'oublie pas que le pH utilise une échelle logarithmique, cela explique pourquoi la courbe après l'équivalence n'a pas une allure simple. Pour obtenir une droite affine, il faudrait réaliser un titrage conductimétrique.
Merci pour cette explication,
pour la concentration en C2O42-,
je pensais faire comme ça :
C2O42- = racine 3 (Kd*cplxe / Al3+)
(on néglige la partie qui complexe Al3+)
Je ne comprends pas bien ton dernier message. A partir de quelle mesure détermines-tu la quantité d'oxalate de sodium introduite par litre ?
Je pensais la trouver grâce à la concentration en Al3+ que j'ai déterminée et qui serait à peu près celle du complexe.
Comment aurais-tu fait ?
Dans ton premier message, il est question de "déterminer la concentration de C2O42- de la solution d'oxalate de sodium grâce au Kd et aux pH mesurés. "
Une méthode possible consiste à mesurer le pH de début de précipitation, c'est à dire le pH du palier qui suit immédiatement la première équivalence (6,78 pour ma simulation) en considérant que ce pH est le pH de début de précipitation en présence des ions oxalate.
Il faut d'abord considérer la concentration en ions aluminium résiduelle résultant de la réaction de complexation en négligeant la formation de précipité d'oxalate d'aluminium.
Soit c1 la concentration initiale en ions aluminium (connue) et soit c2 la concentration initiale en ions oxalate supposée inconnue. Un rapide tableau d'avancement tenant compte du fait que la complexation est quasi totale conduit à l'équilibre à :
Tu sais aussi que le début de précipitation correspond à :
En remplaçant [Al3+] par l'expression précédente et [HO-] par la valeur déduite du pH de début de précipitation, tu obtiens une équation à une seule inconnue c2.
Cette méthode n'est pas très précise puisqu'elle suppose de négliger la présence initiale du précipité d'oxalate d'aluminium. Ton énoncé propose peut-être une autre méthode. Les dosages par potentiométrie des oxalates sont plus précis...
La méthode est certes peu précise mais 22,5mol/L : c'est effectivement beaucoup trop !
Quel est ton pH de début de précipitation ? Voisin de 7 je suppose ?
Que vaut la concentration initiale en sulfate d'aluminium dans les 10mL de solution initiale ?
Si on tient compte de la dilution dû à l'ajout des 100mL de solution d'oxalate de sodium, cela conduit donc à c1=0,02mol/L.
Tu as raison : un pH de 9 conduit à une valeur de c2 totalement irréaliste. Cette valeur me parait beaucoup trop élevée par rapport aux valeurs que j'ai pu simuler. Mes simulations conduisent à une valeur de pH de début de précipitation un peu supérieure à 7... C'est tout le problème des échelles logarithmiques dont je t'ai déjà parlé : une petite erreur de mesure du pH (difficultés d'étalonnage de l'appareil, fiabilité de celui-ci...) entraîne une erreur énorme sur les concentrations... Pour les dosages, il faut privilégier les méthodes où un volume équivalent permet de déduire la concentration inconnue. Les volumes équivalents peuvent être obtenues en général avec une bonne précision car ils correspondent à un changement brutal d'une propriété du mélange : couleur, pH, potentiel d'oxydo réduction, conductivité... Ainsi, même un appareil mal étalonné permet une mesure précise...
Pour la valeur de concentration de Al3+ (et pas celle de Al2(SO4)3 je me suis trompée), c'est la valeur que j'ai déduite grâce à la courbe avec les volumes équivalents. Je m'étais posée la question s'il y avait un facteur de dilution, mais comme j'ai trouvé à peu près cette valeur avec 2 dosages différents je ne pensais pas.
C'est le pH du palier quasi horizontal obtenu juste après la première équivalence. Dans le cas de la simulation fournie précédemment, il vaut 6,8 mais les concentrations que j'ai utilisées ne sont pas celles de ton TP.
A mon avis, il y a un problème de mesure du pH, soit une erreur de manip soit un problème de matériel. Les pHmètres sont des appareils très délicats et capricieux...
Un de mes camarades a la même valeur.
On a le dosage de l'acide (pH=7 à l'équivalence ) puis on arrive à 9.
Quel valeur du pKs de l'hydroxyde d'aluminium utilise-tu ? Dans un énoncé d'exercice j'ai lu : pKs =36,3 mais il semble bien que cette valeur soit fausse. Les différents documents ne donnent pas exactement la même valeur mais la valeur la plus fréquemment citée est pKs=33,5. Il s'agit aussi de la valeur utilisée par mon logiciel de simulation. Voici d'ailleurs une nouvelle simulation faite avec une concentration initiale en oxalate de sodium égale à c2=1mol/L : le pH de début de précipitation est effectivement plus élevé que 7 tout en étant assez inférieur à 9.
Je te propose de refaire le calcul avec cette valeur de pKs ...
Bonne nouvelle : à si faible concentration initiale en ions aluminium, le précipité d'oxalate d'aluminium ne se forme pas...
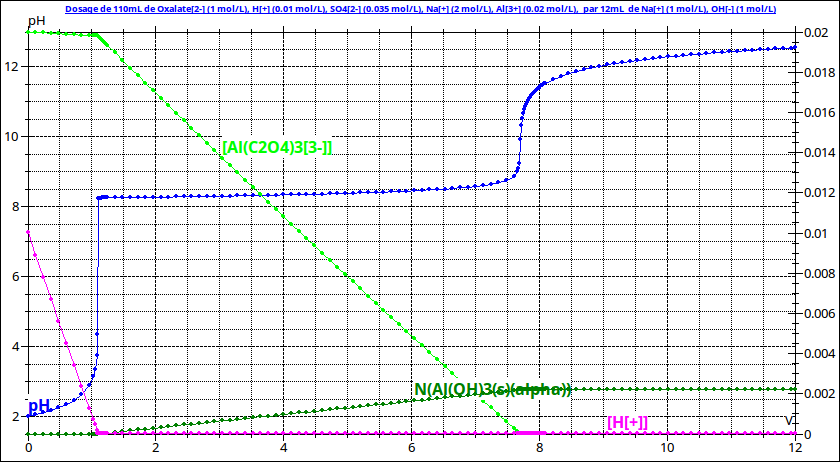
Je te présente le calcul que j'ai fit à partir de la courbe de titrage simulée de mon dernier message. Je tiens compte de la dilution due au mélange des 10mL de solution de sulfate d'aluminium avec les 100mL de solution d'oxalate de sodium ainsi que du volume de soude ajoutée à la première équivalence ve1=1,15mL. La quantité d'ions aluminium par litre de solution est ainsi :
Le pH de début de précipitation étant égal à 8,25 :
La concentration restante en ions aluminium au début de précipitation vaut donc :
En reprenant un raisonnement déjà fait précédemment :
Si on tient compte de la dilution due à l'ajout de la soude :
Le résultat est évidemment cohérent puisqu'il s'agit d'une simulation (j'avais choisi une solution à 1mol/L comme indiqué sur les courbes). A toi de vérifier si tu as bien utilisé la même méthode.
Je n'ai pas compris ton 2 dans C1.
Pourquoi calcules-tu la concentration restante en ions aluminium au début de la précipitation ?
Une solution à c1 mole par litre de Al2(SO4)3 contient 2c1 mole par litre d'ions aluminium.
L'équilibre de complexation fait intervenir les concentrations réelles au début de la précipitation, pas les quantités introduites par litre ! C'est toute la différence entre la notation "c1" et la notation [Al3+ ].