Inscription / Connexion Nouveau Sujet
ClO3- Règle de l'octet et structure de Lewis
Bonjour j'ai un problème avec la règle de l'octet lorsque j'établis la structure de Lewis de l'ion ClO3-
j'ai calculé que j'avais 13 doublets a placer cependant lorsque je recompte mes électrons j'en trouve 8 pour les O et 12 pour le Cl
j'ai fais le même travail avec d'autres ions ( NO2-) je n'ai pas eu ce problème
Est une exception à la règle de l'octet ?
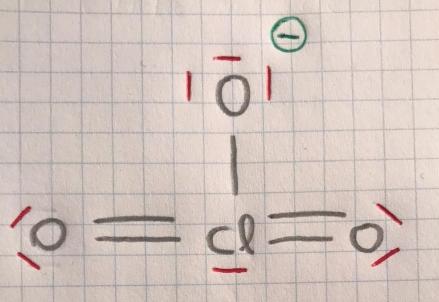
Bonsoir
Tu as raison. Le chlore est ici en situation d'hypervalence ce qui confère à l'ion chlorate un caractère peu stable et fortement oxydant.
Merci il est cependant étrange que cette exception à la règle de l'octet de ne soit pas répertorié dans mon cours
savez vous si c'est les cas pour beaucoup d'autres composés ?
Voici quelques exemples ici : ![]()
La règle de l'octet à l'avantage de la simplicité mais ne fonctionne correctement que pour les atomes de numéros atomiques peu élevés (les deux premières lignes du tableau périodique essentiellement). Au-delà, il faut utiliser des théories plus élaborées faisant intervenir la mécanique quantique et la notion d'orbitales atomiques et d'orbitales moléculaires.


