Inscription / Connexion Nouveau Sujet
cinétique chimique 2
 etudiantilois
etudiantiloisBonjour,
Je n'arrive pas à faire l'exercice suivant, portant sur les facteurs de la cinétique chimique et les lois de vitesse. J'ai mis ci-dessous mes pistes de recherche.
On considère, en phase gazeuse, la réaction de décomposition du peroxyde de ditertiobutyle :
(CH)3C-O-O-C(CH3)3 -> 2 CH3-CO-CH3+C 2H6.
Le peroxide est introduit en concentration C0 dans un réacteur isochore (de volume constant) que l'on maintient à température constante. On relève les valeurs de la pression en fonction du temps. La pression initiale sera notée P0.
1) Quelle est la relation existante entre C, concentration du réactif à l'instant t et P, pression totale à l'instant t ?
2) On suppose que la vitesse de réaction est de la forme V = k [réactif] avec k constante.
Vérifier dans ce cas que l'on a alors Ln[(2P0)/(3P0-P)]=kt.
3) A partir des résultats expérimentaux suivants établis à T=147°C, déterminer la constante k définie au 2).
t/min 0 5 10 15 30 50
p/hPa 250 272 293 313 368 431
Voici ce que j'ai essayé de faire :
1) Je n'ai trouvé aucune formule permettant de relier toutes ces valeurs, et cela m'inquiète beaucoup… Comment faire ?
2) Je n'y arrive pas…
3) Idem, je pense qu'il faut trouver l'ordre de la réaction pour résoudre la question, mais je ne sais même pas comment trouver l'ordre de cette réaction…
Merci beaucoup d'avance pour votre aide, cela m'inquiète de ne rien trouver...
Bonne journée.
Bonjour
1 : tu connais sûrement la loi des gaz parfaits...
2 : si on note R, pour alléger l'écriture le peroxyde de tertiobutyle, on obtient l'équation différentielle du premier ordre :
Tu dois être capable d'intégrer puis d'utiliser la loi des gaz parfaits...
mais je ne sais même pas comment trouver l'ordre de cette réaction…
Ou tu ne lis pas correctement l'énoncé, ou tu n'as absolument pas compris ton cours ! Il faut commencer par assimiler le cours avant de se lancer dans la résolution des exercices !
Éventuellement pour t'aider : voici une fiche qui résume l'essentiel du cours sur le sujet :
Bonjour,
Merci pour votre aide.
1) La loi des gaz parfaits est : PV=nRT donc PV = cVRT donc P=cRT. C'est correct ?
Que faire de R ?
2) On n'a pas encore appris en maths comment résoudre une équation différentielle... Et comment avez-vous obtenu cette équation différentielle... Je suis perdu...
3) ??
En tout cas, merci beaucoup pour la fiche, indispensable. Mais je n'ai pas compris comment trouver l'ordre dans ce cas ?
Vraiment désolé si c'est une question complètement idiote, mais je ne comprends pas...
MERCI.
Tu n'as manifestement rien compris à ton cours ... Sans doute pourtant le plus facile du programme de math Sup... Inutile dans ces conditions d'aborder la résolution d'exercices...
Un conseil : essaie de bien comprendre le résumé que je t'ai fourni dans mon message précédent, en particulier les premiers paragraphes sur le tableau d'avancement, les ordres partiels et l'ordre total. Pose des questions sur ce que tu ne comprends pas sur ce document...
Tu es tellement loin du niveau requis pour aborder ce genre d'exercice que, sans ce travail préalable, tu n'as aucune chance de comprendre durablement un quelconque corrigé que je pourrais te fournir...
Merci.
Pour commencer, je ne comprends pas quelles sont les étapes à la place de la flèche sur la pièce jointe... Et que représente [Ai]
Pourriez-vous m'expliquer svp ?
MERCI BEAUCOUP.
NB pour la modération : j'ai mis une image car les formules auraient été totalement illisibles en texte... Merci pour votre compréhension.
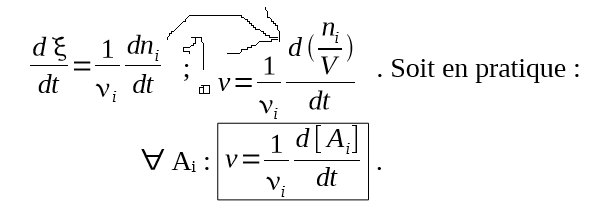
Pour passer de à la vitesse v, il faut diviser l'expression par le volume. Par hypothèse (lis bien les conditions d'étude précisées au début de la fiche), le volume est fixe donc :
D'accord, merci beaucoup.
Pour la 1 : La loi des gaz parfaits est : PV=nRT donc PV = cVRT donc P=cRT. C'est correct ?
Pour la 2 : je pense qu'il faut utiliser la formule v=(1/V)*(d /dt).
/dt).
Mais je ne suis pas sûr... Que faire ?
Pour la 3 : j'ai pensé à faire un graphique, mai là je ne saurais pas comment l'exploiter...
Comment faire ?
Merci beaucoup pour votre aide.
Pour simplifier les notations, j'écris la réaction sous la forme :
A  2B + C
2B + C
Je remplis un tableau d'avancement en notant x l'avancement volumique :
| espèces chimiques | A | B | C | total gaz |
| Concentrations initiales | Co | 0 | 0 | Co |
| Concentrations à la date t | C=Co-x | 2x | x | Co+2x |
A T et V fixe, la pression est proportionnelle à la quantité totale de gaz donc aussi à la concentration totale en gaz puisque V est fixe :
Je te laisse exprimer x en fonction de P, Po et Co. Il te sera facile ensuite de démontrer :
Ensuite, il faut supposer une cinétique du premier ordre et... Je te laisse continuer.
Bonsoir,
Merci pour votre réponse.
Comment peut-on exprimer x en fonction de P, Po et Co ? J'ai essayé de le faire avec le tableau d'avancement, mais je n'ai pas réussi...
Ensuite, pourquoi faut-il supposer une cinétique du premier ordre ? Comment utiliser ensuite cela ?
Merci beaucoup pour votre aide.
Je me demande dans quelle mesure tu comprends ce que tu lis...
Comment peut-on exprimer x en fonction de P, Po et Co ?
Je t'ai fait la démonstration dans mon message précédent en écrivant en toutes lettres la relation que tu cherches : que te faut-il de plus ?
Ensuite, pourquoi faut-il supposer une cinétique du premier ordre ? Comment utiliser ensuite cela ?
La réponse est dans l'énoncé : "On suppose que la vitesse de réaction est de la forme V = k [réactif] avec k constante. "
Cela donne :
Tu as surement appris en cours de math à résoudre une équation différentielle de ce type. On obtient :
Remplace (Co/C) par son expression en fonction de la pression et , comme par hasard (!) tu vas tombrer sur l'espression proposée en fin de question 2...
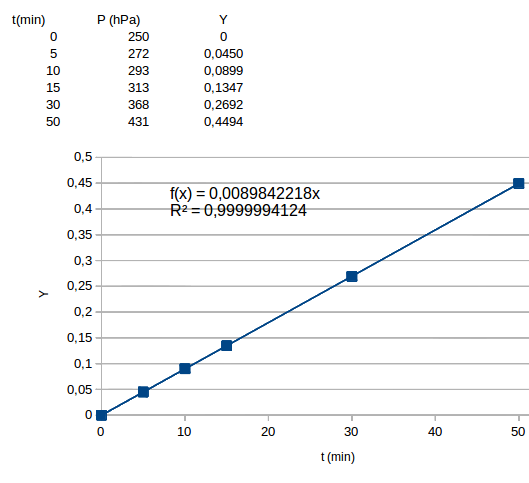
Question 3 : pour chaque point expérimental, tu calcules
Merci infiniment pour votre réponse.
Donc Co/C, c'est bien (2Po)/(3Po-P) ?
Et pour calculer la valeur Y, comment peut-on faire car on ne connaît pas Po ?
Pour la question 1, je ne sais toujours pas, il faut répondre : La loi des gaz parfaits est : PV=nRT donc PV = cVRT donc P=cRT ? Sauf qu'on nous demande une relation entre C et P, ce qui n'est pas le cas ici ? Où me suis-je donc trompé ?
Merci pour votre aide.
Voici la courbe et l'équation de la droite de tendance. Les points sont tellement bien alignés avec l'origine du repère que cela parait suspect...
Merci beaucoup !
Il me reste 3 questions :
1) Comment avez-vous déterminé Y à chaque fois ? Quelle valeur de Po avez-vous prise ?
2) Pour la question 1, je ne sais toujours pas, il faut répondre : La loi des gaz parfaits est : PV=nRT donc PV = cVRT donc P=cRT ? Sauf qu'on nous demande une relation entre C et P, ce qui n'est pas le cas ici ? Où me suis-je donc trompé ?
3) Pour mon autre exercice de chimie intitulé cinétique chimique, quand il faut utiliser le cas t=2h, on met t en secondes, en minutes, ou en heures ?
MERCI.
Quelle valeur de Po avez-vous prise ?
Je me suis contenté de lire le tableau de mesure qui précise que, pour t = 0, P=250hPa.
P=cRT ?
oui mais comme R et T sont des constantes ici, je me suis contenté d'écrire que P est proportionnelle à la concentration totale en gaz. J'ai déjà écrit cela !
Sauf qu'on nous demande une relation entre C et P, ce qui n'est pas le cas ici ?
manifestement : simple oubli de l'énoncé car, à la ligne suivante, ce même énoncé fait bien intervenir Po.
quand il faut utiliser le cas t=2h, on met t en secondes, en minutes, ou en heures ?
On peut faire comme on veut ! L'essentiel est d'être cohérent et de bien exprimer l'unité de k en tenant compte de ce choix.
D'accord, merci.
Donc pour la question 1, la réponse est bien P=cRT ?
Ou il y a autre chose de mieux ?
Merci encore pour votre aide.



