Inscription / Connexion Nouveau Sujet
Chromatographie
Bonjour, on me donne l'exercice suivant et je ne sais pas trop quoi faire ...
On effectue le dosage par CPG de l'éthanol dans un vin dont la concentration affichée est de 12,5 %. On prépare une gamme d'étalonnage, de 4 à 16 % d'éthanol dans 4 fioles jaugées numérotées de 10 mL de contenance, comme suit : de 0.4 à 1.6 mL d'éthanol absolu (E), 1 mL de propanol (P), chaque fiole étant complétée à 10 ml avec de l'eau distillée. Pour l'échantillon V, dans une fiole de 10 ml, verser 1 ml de propanol et compléter avec le vin à analyser. Toutes les fioles sont diluées au centième. On injecte 1 L dans le chromatographe pour chacune des solutions à analyser. Les résultats sont les suivants:
L dans le chromatographe pour chacune des solutions à analyser. Les résultats sont les suivants:
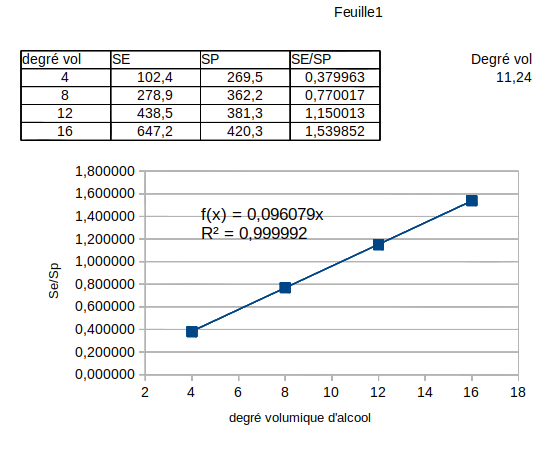
Fiole N° : 1 2 3 4 V
Surface du pic E: 102.4 278.9 438.5 647.2 342.9
Surface du pic P: 269.5 362.2 381.3 420.3 317.5
Donner la concentration de l'échantillon V et du vin en éthanol. Quel est le rôle du propanol ? Expliquer.
Quelqu'un pourrait-il me guider ?
Merci par avance 
Tu as sûrement raison : pour les fioles étalons, le rapport des surfaces Se/Sp pour les fioles étalons est bien ainsi proportionnel au pourcentage volumique d'alcool.
Les choses sont un peu plus simples que dans le document que je t'ai fourni dans la mesure où la quantité de propanol et donc la concentration en propanol est constante. D'autre part la concentration en éthanol est proportionnelle au pourcentage volumique d'éthanol, ce qu'on appelle le degré d'alcool d.
Il te suffit à l'aide d'un tableur ou d'une calculatrice scientifique de montrer que, pour les 4 solutions étalons, le rapport Se/Sp est proportionnelle à d. Une fois connue la constante de proportionnalité, la valeur du rapport Se/Sp pour la fiole contenant le vin permet de calculer d pour le vin.
J'ai cette équation de droite....
Comme y = 9.6492 x - 0.005
et que y = 342.9/317.5 = 1.08
alors 1.08 = 9,6492 x -0.005
x = 0.112
Donc on aurait environ 1.12 mL d'éthanol dans V.
Mais qu'en est il avec la dilution ? et dans le vin ?
Donc on aurait environ 1.12 mL d'éthanol dans V.
C'est cela. Ces 1,12mL (1,124mL si on garde un chiffre significatif de plus) provenait de 9mL de vin donc dans 100mL de vin... Les mesures sont très cohérentes même tellement bonnes qu'elles en paraissent suspectes...
La dilution au centième n'intervient pas directement puisqu'elle est la même pour toutes les expériences. Elle est en quelque sorte inclue dans la constante de proportionnalité entre le rapport SE/SP et le degré d'alcool.
Je veux bien répondre à ta dernière question mais avant, j'aimerais savoir si tu as bien compris le rôle de la présence d'une quantité fixe de propanol dans toutes les fioles. C'est expliqué dans le document que je t'ai fourni mais le raisonnement utilise les concentrations...
Je veux bien fournir une réponse un peu générale : la concentration molaire d'une espèce donnée (l'éthanol par exemple) est proportionnelle à sa proportion volumique dans l'échantillon donc, pour l'éthanol, au degré d'alcool...
Si tu pouvais un peu mieux préciser ce que tu ne comprends pas bien... Je pense que tu as quand même compris l'essentiel puisque tu as obtenu le résultat demandé.
Le propanol est l'étalon interne et est en quantité fixe. Il sert de référence pour l'analyse. mais la concentration molaire est c = n/v; or je n'ai pas de nombre de moles ici ...
Imagine que le volume injecté dans le dispositif de mesure par CPG soit rigoureusement égal à 1µL comme indiqué par ton énoncé. La quantité de propanol injecté serait la même pour toutes les fioles et donc Sp aurait même valeur pour toutes les fioles... On constate expérimentalement qu'il n'en est rien : cela prouve que le volume injecté dans l'appareil de mesure n'est pas fixe et varie aléatoirement.
Les lois de la chromatographie enseignent que, pour un échantillon donné, le rapport (Se/Sp) est proportionnel au rapport des quantités d'éthanol et de propanol injectées et est donc indépendant du volume injecté. Ce rapport (Se/Sp) est aussi proportionnel au rapport des volumes de E et de P injectés. Comme le volume de P injecté est fixe, le rapport (Se/Sp) est proportionnel au volume d'éthanol introduit dans la fiole. C'est bien ce que prouve la courbe d'étalonnage tracée.
Concernant les concentrations en éthanol : tu as montré que l'échantillon V contient 1,124mL d'éthanol. Connaissant la masse volumique de l'éthanol, tu peux déterminer la masse d'éthanol présente dans les 10mL de l'échantillon V. Connaissant la masse molaire de l'éthanol, tu en déduis la quantité d'éthanol présente dans les 10mL de V puis la concentration molaire. Sachant que 100mL de vin contient 12,5mL d'éthanol, le calcul est analogue, mais tu peux directement dire qu'il s'agit des (10/9)ième de la concentration précédente...
0.79 = m / 0.01
m = 7.9 g
c = n/v = m/ M*V = 7.9/ (46*0.01) = 17.17 mol/L
J'ai ça mais après je ne sais vraiment pas ...
Je te fais le calcul dans le cas du vin à 12,5°. Un litre de vin contient 125mL d'éthanol soit une masse d'éthanol par litre égale à :
cm=0,79*125=98,75g/L
(La masse volumique de l'éthanol vaut 0,79g/mL)
La concentration molaire est égale à la concentration massique divisée par la masse molaire :
Je te laisse calculer la concentration dans la fiole V...