Inscription / Connexion Nouveau Sujet
Chimie organique 2
 etudiantilois
etudiantiloisBonjour,
Dans un livre de chimie, je lis : "Pour déprotoner quantitativement un acide il faut utiliser une base plus forte que la base que l'on souhaite former."
Mais pour faire "l'inverse", est-ce correct d'écrire "pour protoner quantitativement une base il faut utiliser un acide plus faible que l'acide que l'on souhaite former." Est-ce bien cela qu'il faudrait écrire ? Si non, je ne comprends vraiment pas pourquoi...
Merci pour l'aide d'avance !
Bonjour
La phrase que tu cites est une conséquence de celle que tu connais sûrement : "le sens de la réaction quasi totale (quantitative) correspond à la réaction de l'acide le plus fort sur la base la plus forte". Tout est résumé sur le diagramme des pKa ci-dessous. Le sens de la réaction quasi totale correspondant à la règle bien connu du gamma. Pour pouvoir considérer la réaction comme quasi totale, il faut une constante de réaction supérieure à 104 environ soit un écart de pKa d'au moins 4.
Essaye de bien comprendre le diagramme et tu verras si la seconde proposition de ton message est correcte.
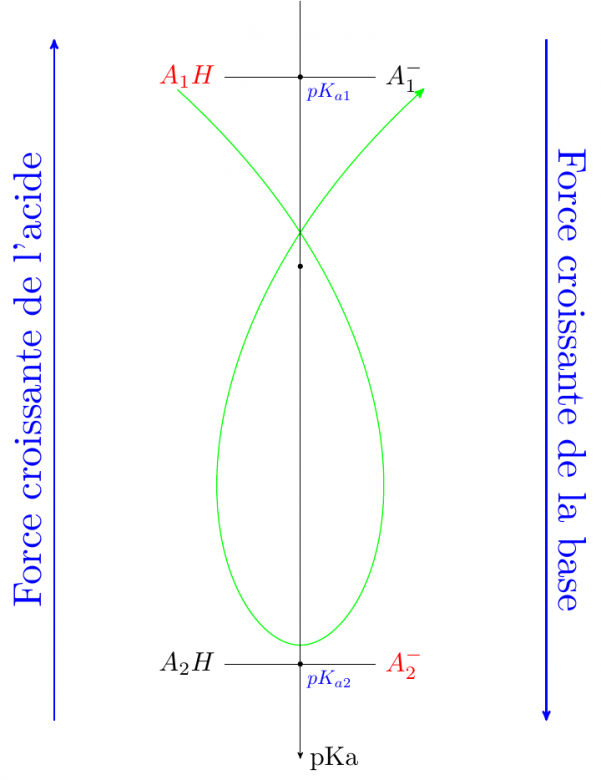
Merci beaucoup pour votre réponse.
Avec votre schéma, je dirais plutôt : "pour protoner quantitativement une base il faut utiliser un acide plus FORT que l'acide que l'on souhaite former".
Est-ce mieux ?
J'ajoute (encore, désolé...) une question : pourquoi l'acide (Z)-but-2-ènedioïque et l'acide (E)-but-2-ènedioïque sont-ils des diastéréoisomères ?
De mon côté j'aurais plutôt dit que ce sont des énantiomères étant donné qu'il y a inversion des descripteurs stéréochimiques...
Merci encore !


