Inscription / Connexion Nouveau Sujet
Chimie: mésomerie
Bonjour j'ai une question concernant la mésomerie quand on déplace les électrons il faut conserver le nombre de hydrogène je ne comprends pas
Exemple :
Ch3-C=Ch-Ch=Ch-Ch-Ch3
|
Ch3
Je ne comprends pas quand il faut mettre la paire libre sur le carbone
Ch3-C-Ch=Ch-Ch=Ch-Ch3
|
Ch3
Ou
•• -
Ch3-C-Ch=Ch-Ch2 -Ch-Ch3
|
Ch3
Quelqu'un peut m'explique s'il vous plaît.
Merci d'avance
Bonsoir
Attention : ta formule ne respecte pas la règle de l'octet !
Sinon : les formes mésomères résultent de délocalisations des électrons "pi" des atomes de carbone.
Partant de la structure respectant la règle de l'octet (centre du schéma), on obtient la structure de gauche en imaginant que les deux électrons de la liaison "pi" entre C2 et C3 passent entre C3 et C4, y créant une liaison "pi" et faisant apparaître une lacune électronique sur C2. Cela s'accompagne de la migration des deux électrons"pi" de la liaison C4-C5 sur C5 qui respectent bien la règle de l'octet mais se trouve ainsi avec un électron excédentaire.
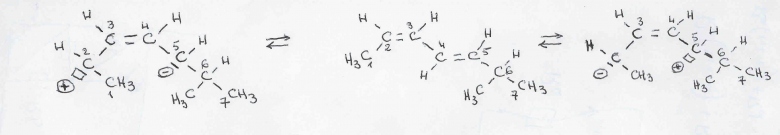
Et le nombre de hydrogène et le même pour toute les structures de mesomerie possible pour une molécule ?
Et le nombre de hydrogène et le même pour toute les structures de mesomerie possible pour une molécule ?
Bien sûr !
Les différentes formes mésomères possibles diffèrent seulement par des localisations différentes d'électrons
 . En fait, les électrons
. En fait, les électrons  , au lieu de rester localisés entre des atomes précis pour former des liaisons
, au lieu de rester localisés entre des atomes précis pour former des liaisons  (entre C2 et C3 ainsi qu'entre C3 et C4 dans ton exemple) se déplacent sur l'ensemble de la chaîne carbonée (entre C2 et C5 dans ton exemple). On parle de liaisons
(entre C2 et C3 ainsi qu'entre C3 et C4 dans ton exemple) se déplacent sur l'ensemble de la chaîne carbonée (entre C2 et C5 dans ton exemple). On parle de liaisons  délocalisées.
délocalisées.

