Inscription / Connexion Nouveau Sujet
Chimie cinétique
S2O8 2- + 2I- -> 2SO4 2- + I2 (1)
2SO3 2- + I2 -> S4O6 2- + 2I- (2)
La réaction (2) est très rapide, l'iode moléculaire (I2) est donc rapidement retransformé en iodure (I-). En tenant compte des 2 réactions, quel est l'impact sur la concentration globale en iodures ([I-]) ? Quelle simplification peut-on alors faire sur la loi de vitesse?
Bonjour , cela se dit, je te l'assure ...
peux-tu renseigner ton profil s'il te plaît ? et dire ce que tu as cherché et ce qui te bloque
je te remercie

Bonjour, j'ai trouvé la réponse à ma question précédente.
v = - d[S2O8 2-] / dt = k' [S2O8 2-]^n avec k' = k [I-]^m
Et maintenant, on demande que par intégration de l'expression de la vitesse de réaction d'écrire la relation liant le temps à la concentration en S2O8 2- pour n = 0, 1 et 2 et je ne sais pas comment trop faire. Merci et que voulez vous dire par mon profil?
profil : renseigner le niveau
 extrait de
extrait de Q12 - Dois-je forcément indiquer mon niveau lorsque je poste un nouveau topic ?
tu vas dans ton espace membre, puis "mon profil"
Bonjour
En notant C et Co la concentration et la concentration en ions peroxodisulfate, il te faut établir dans chacun des trois cas la loi C=f(t) .
Cela te ramène à résoudre trois équations différentielles du premier ordre, le cas particulier n=0 étant particulièrement évident. Je te laisse réfléchir et proposer une solution...
Voila ce que j'ai trouvé même si je pense que c'est mauvais:
n=0: [S2O8 2-] = -k*[I-]^m * t
n=1: ln[S2O8 2-] = -k*[I-]^m * t
n=2: ln([S2O8 2-])^2 / [S2O8 2-] = -k*[I-]^m * t * 2
Pas vraiment. Il s'agit de résoudre l'équation différentielle de variable C=f(t) :
Situation n=0 :
Facile à intégrer non ? Pense éventuellement à l'étude d'un mouvement rectiligne uniforme...
Ensuite, pour n=1, tu obtiens une équation différentielle d'un type sûrement étudié en cours de math :
Je te laisse réfléchir et proposer une solution.
Avec k' étant une constante?
Je croyais que tu avais compris que oui. Je reprends à zéro.
Dans le cas général :
L'énoncé précise que, dès que deux ions iodure disparaissent par la réaction 1, ils sont de façon quasi instantanée régénérés par la réaction 2 dans la mesure où la réaction 2 est beaucoup plus rapide que la réaction 1. On est ainsi amené à étudier la réaction de réduction des ions peroxodisulfate par les ions iodure à concentration fixe en ions iodure :
avec [I-]o : concentration initiale en ions iodure.
Est-ce qu'on doit intégrer entre les bornes t0 et tf? sinon voici mes résultats:
n=0: C=-k't
n=1:C=e-k't
n=2:C=1/k't
Tu cherches dans les bonnes directions mais tu n'y es pas tout à fait : ne pas oublier que C=Co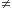 0 à la date t=0 !
0 à la date t=0 !
J'ai réussi à trouver les bonnes valeurs pour cette question, merciiii.
Ensuite, il est demander de faire un tableau d'avancement (en moles) de la réaction étudiée (réaction (1) )
au cours du temps (pour t=0 et t quelconque avant la fin de la réaction)
Les différentes expériences sont décrites au point 2). Vous disposez pour
chacune de 100 mL de S2O8
2- de concentration 7,4*10-3 M mélangé à 100 mL
de KI de concentration variable.
Nous considèrerons les ions iodures (I-) en excès dans la réaction (1) pour
simplifier. Est-ce que le nbre de moles de S2O8 2- tombe à zéro au temps t ou non?
Oui : la réaction est totale mais relativement lente ; si on trace la courbe [S2O82-]=f(t) : on obtient une courbe qui admet comme asymptote horizontale la valeur nulle mais cette asymptote n'est pas atteinte au cours de l'étude faite ici.
Si je comprends bien, il s'agit maintenant d'étudier l'ordre partiel par rapport aux ions iodure. Sans un énoncé complet, impossible de t'aider vraiment...
Voilà l'énoncé: L'expérience a été répétée à des températures différentes (18°C, 24°C, 28°C et
31°C) et pour des concentrations initiales en iodure différentes (0,5 M ; 0,375 M et
0,25M). Pour chaque expérience, un tableau vous est fourni sous format Excel. A
une température donnée, 3 expériences différentes sont donc réalisées :
- Expérience 1 : 100 mL de solution de persulfate de potassium K2S2O8 7,4.10-3
mol/L ; 100 mL de solution d'iodure de potassium KI 0,5 mol/L ;
- Expérience 2 : 100 mL de solution de persulfate de potassium K2S2O8 7,4.10-3
mol/L ; 100 mL de solution d'iodure de potassium KI 0,375 mol/L ;
- Expérience 3 : 100 mL de solution de persulfate de potassium K2S2O8 7,4.10-3
mol/L ; 100 mL de solution d'iodure de potassium KI 0,25 mol/L ;
Pour chaque expérience, on a utilisé une solution de thiosulfate de sodium Na2S2O3
0,05 mol/L et la quantité d'iodure de potassium KI est en excès par rapport à la quantité
de persulfate de potassium K2S2O8 Et à partir de ça, j'ai plusieurs questions.
OK mais sans les questions... ; je sais que tout cela est effectivement long à copier. Je te rappelle le règlement du forum : si l'énoncé est plus long que l'équivalent d'une page format A4, ce qui souvent le cas des fiches de T.P. , tu peux poster sur le net le fichier complet au format pdf et indiquer ici un lien permettant de le consulter.
Je dois établir un tableau d'avancement de la réaction (2) au cours du temps et établir le lien entre la quantité de mole I2 produite par la réaction (1) et le volume ajouté de S2O3 2- 0,05M et je ne sais pas comment m'y prendre.
Voici un exemple de tableau d'avancement pour la réaction (1) :
| Espèces chimiques | S2O82- | I- | SO42- | I2 |
| Quantités introduites (mol) | 7,4.10-4 | 0,05 | 0 | 0 |
| Quantités à la date t (mol) | 7,4.10-4-x | 0,05-2x 0,05 0,05 | x |
La quantité d'ions disulfite nécessaire à doser le diiode formé est égale à 2x mais aussi égale au produit de la concentration de cette solution par le volume versé, mesuré en litre.

 équivalences des systèmes de niveaux scolaires
équivalences des systèmes de niveaux scolaires
