Inscription / Connexion Nouveau Sujet
Chimie : cinétique
 etudiantilois
etudiantiloisBonsoir,
J'ai des difficultés avec l'exercice ci-dessous.
On réalise l?hydrolyse de l?ion fumarate F par l?eau en ion maléate M, catalysée par l?enzyme fumarase E, selon l?équation bilan F + H2O = M, pour une concentration initiale en enzyme [E]0=1,0.10-6 mol.L-1.
La mesure de la vitesse volumique globale de la réaction pour différentes
concentrations en substrat F a donné les résultats suivants : (voir tableau ci-dessous).
Calculer la constante de Michaelis-Menten de cette réaction, ainsi que la vitesse maximale pour cette concentration initiale en enzyme.
Je ne vois pas vraiment comment faire, et je ne trouve rien dans mon cours pour répondre à la question...
Il faut utiliser un tableur ?
Merci par avance pour l'aide !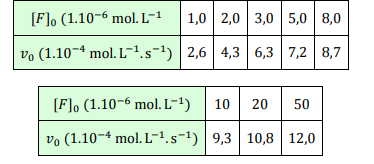
***Titre complété***
Bonjour
Tu connais sûrement l'expression de vo en fonction de vmax, KM et [F]o.
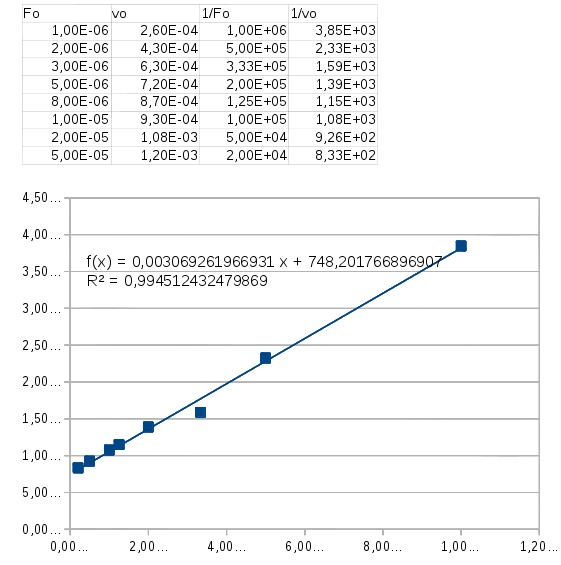
La méthode la plus classique pour déterminer KM et vmax consiste à représenter à placer dans un repère les points d'abscisses (1/[F]o) et d'ordonnées (1/vo). Si la loi cinétique est bien vérifiée, les points doivent être sensiblement alignés le long d'une droite moyenne.
L'intersection de l'axe des abscisses avec le prolongement de cette droite moyenne permet d'obtenir KM, le coefficient directeur de cette droite moyenne permet d'obtenir vmax.
Je te laisse réfléchir et chercher la solution.
L'utilisation d'un tableur ou de tout autre logiciel de traitement de données est vivement recommandé ! 
Oui, on a :
v0=
C'est bien ça ?
Mais pourquoi cela nous aiderait si on fait ça graphiquement avec la droite ?
Merci pour cette aide !
Pose x=1/[F]o et y=1/vo.
L'équation que tu viens d'écrire conduit à
y=A. x+B
Un tableur va te donner les valeurs de A et de B...
Tu en déduira les valeurs de KM et de vmax .
L'équation que tu as écrite peut aussi se mettre sous la forme :
Cela est bien de la forme : y=A.x + B avec les notations que j'ai précisées dans mes messages précédents...
Tu postes tout de même au niveau enseignement supérieur...
Effectivement, je comprends mieux !
Désolé, je suis un peu fatigué, j'ai beaucoup de travail...
D'autre part, j'aurais beaucoup de questions à poser sur l'île cet été, est-ce que vous serez disponible en juillet et en août pour y répondre ?
Merci beaucoup !
Voici les résultats obtenus avec un tableur. La loi cinétique est assez bien vérifiée puisque les points, à une exception près, sont très proches de la droite moyenne dont l'équation est précisée sur le graphe ainsi que le carré du coefficient de régression qui est très proche de 1. Je te laisse gérer les unités et le nombre de chiffres significatifs. Il te reste à déterminer les deux constantes KM et vmax.