Inscription / Connexion Nouveau Sujet
Chimie : acide base
Bonjour, je ne comprends pas cet exercice. Je n'arrive pas à le commencer car on n'a pas le volume total qu'il faut pour déprotoner complètement l'acide triprotique.
Voici l'énoncé :
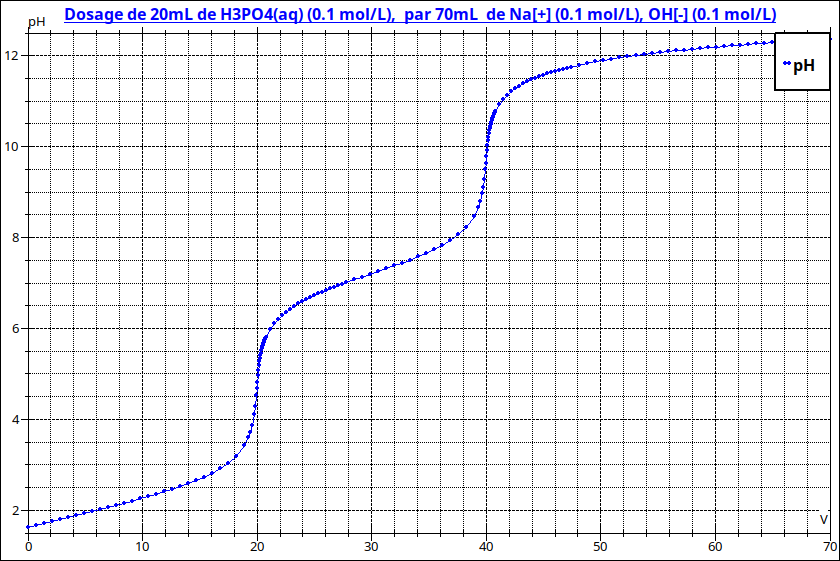
"Parmi les indicateurs colorés proposés, lequel ne pourrait pas être utilisé pour le titrage d'une solution 0,1 M d'acide phosphorique (H3A) par une solution 0,1 M de NaOH ? (Nous supposons ici que les 3 sauts de pH sont observables).
1) rouge de méthyle
2) thymolphtaléine
3) bleu d'epsilon
4) jaune d'alizarine
5) vert de bromocrésol"
D'avance merci. Bon après-midi.
Bonjour
Tu dois connaître les zones de virages des différents indicateurs.
Concernant l'acide phosphorique, le troisième saut de pH n'est pas toujours observables, . Dans tous les cas, il est très peu marqué et est difficile à détecter avec un pH-mètre. L'usage d'un indicateur coloré ne sera donc pas précis.
La première équivalence se produit en milieu nettement acide ; la seconde pour pH assez proche de 7.