Inscription / Connexion Nouveau Sujet
Charge élec. en fonction pH
Bonjour,
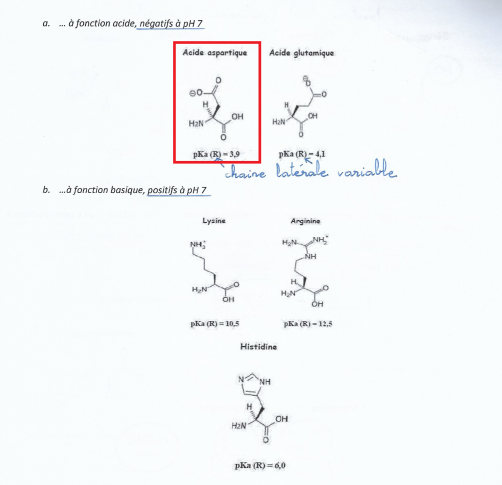
En pièce jointe se trouve une page de mon cours sur les acides aminés. On n'y apprend qu'une catégorie d'acide aminée a une fonction chargée négativement ou positivement dans leur chaine latérale, en fonction du pH.
Dans mon cours, nous nous intéressons au cas précis où le pH =7.
Nous devons apprendre les pKa de chacun de ces molécules d'acides aminés.
Prenons l'acide aspartique (encadré en rouge dans la pièce jointe) en exemple.
Nous connaissons le pKa de la chaine latéral (c'est à dire pKa(R)) de l'acite aspartique qui vaut 3.9. Pour un pH = 7, cette chaine latérale porte une charge négative. Devons nous retenir "bêtement" que cette charge est négative, ou y a t il un raisonnement logique à adopter pour trouver ce résultat ? Comment dois je faire ?
Merci de votre attention,
(merci pour ta patience vanoise, et du temps que tu m'accordes !)
Ton acide aminé possède un groupement carboxylique susceptible de se transformer en COO- ( propriétés acides ,pKa voisin de 4 - 5) et un groupement NH2 qui peut se transformer en NH3+ (propriétés basiques pKa voisin de 9). Tout dépend du pH. Tu as sûrement étudié dans le secondaire la notion de domaines de prédominance...
Pas sûr qu'il s'agisse du bon schéma joint au message...
Tu as dis qu'un acide aminé "possède un groupement carboxylique susceptible de se transformer en COO- et un groupement NH2 qui peut se transformer en NH3+ ".
Est ce que c'est valable avec TOUT les acides aminés (acide aminé apolaires hydrophobes, polaires neutres, polaires ionisables) ? ou seulement la dernière catégorie.
Tu as dis que tout dépendait du pH => en fait, on s'intéresse au cas où le pH = 7
J'espère que mon schéma pourra t'aider.
C'est vrai a priori dans tous les cas mais, pour une réponse précise, il faut connaître les valeurs des deux pKa et le pH de travail (connu ici et égal à 7).
A pH=7 : quand le pKa de la fonction acide est de l'ordre de 4, COOH est transformé en COO-. Pour savoir si NH2 est transformé en NH3+, il faut connaître le second pKa, la réponse est affirmative s'il est de l'ordre de 9.
Est ce que ce schéma peut t'aider ?
Quel est la suite du raisonnement ? Comment aboutit ou à une fonction portant une charge négative pour le pH =7 (avec l'acide aspartique).
Mais je ne saisis pas pourquoi s'interesse t'on à COOH et NH2. Car d'après le cours, (ma première pièce jointe, c'est la fonction qui est chargée négativement ou positivement...Peut tu m'éclairer s'il te plait ?

Je me demande si tes idées sont très claires sur la notion de couple acide/base et sur la notion de domaine de prédominance. Cette fiche pourra peut-être t'aider :
![]()
Sinon le tableau fourni dans ton dernier message résume bien la situation et est totalement en accord avec ce que j'ai écrit dans mes précédents messages. La structure neutre n'est pas obtenu seulement à pH=pI.
En étudiant la fiche que je viens de t'indiquer et dans le cas où les pKa valent 4 et 9, tu peux distinguer 3 cas ; je ne précise que les éventuelles transformations des groupes COOH et NH2 :
pH<3 : COOH et NH3+ : ion positif
5<pH<8 : COO- et NH3+ : molécule : structure électriquement neutre mais portant une charge locale + et une charge locale - : un zwitterion
pH>10 : COO- et NH2 : ion négatif.
A adapter aux différents acides aminés en fonction des valeurs des deux pKa.