Inscription / Connexion Nouveau Sujet
Calorimétrie ( température et chaleur )
Bonjour à tous,
Voici un petit exercice que j'ai fait mais dont je ne suis pas sur des résultats.
L'énonce : Un véhicule roulant à la vitesse constante de 108km.h-1, sur une route horizontale, consomme 5L de carburant au 100km. Le moteur thermique du véhicule délivre alors une puissance mécanique P = 18kW
On donne le pouvoir calorifique massique de l'essence : PC = 50.10^3 kJ.kg-1 et sa masse volumique de 800 kg.m^-3
1) Calculer la quantité de chaleur, c'est-à-dire l'énergie thermique Eth, produite par la combustion de l'essence pendant 1 heure de trajet.
2) Calculer le travail mécanique W fourni par le moteur pendant cette durée
3) Calculer le rendement du moteur
Tout d'abord pour la question n°1, voici ce que j'ai fait :
Q = P * t
Q = 18000 * 1
Q = 18000 Wh
On sait que 1Wh = 3600 J
soit 18000Wh = 64800000 J
donc Q = 6,48.10^5 J
Question n°2 :
Wcycle = -Qcycle
Wcycle = - 6,48.10^5 J
Pour la question 3 je n'ai pas trouver de solution.
Je reste toutefois très septique sur les résultats obtenu précédemment.
Merci d'avance pour vos réponses et votre attention.
Salut,
Je ne suis pas sûr que c'est 18kWh, normalement une puissance est pour 1 seconde mais tu as peut-être raison.
En admettant que c'est juste:
L'énergie que tu as calculer en 1 est l'énergie utilisée par le moteur, mais ce n'est pa l'énergie thermiaque sino le rendement serait de 1.
Eth= Volume*densité*PC
3) rendement= 6,48.10^5/Eth
selon cette valeur on saura si ce que tu as fait pour le calcul du travail mécanique est juste ou non
Re Lamat,
Eth = Volume * densité * PC
Pour la densité, je pense que cela correspond à la masse volumique soit 800kg.m^-3, le PC est donc de 50.10^3 kJ.kg-1, cependant pour le volume je suis perdu, y a t-il une formule pour le calculer à partir de ce que l'on a ?
En effet, la seule formule que je connaisse en rapport avec le volume est la suivant : 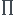 * course * (alésage)^2 / 4
* course * (alésage)^2 / 4
à la vitesse constante de 108km.h-1, on consomme 5L de carburant au 100km.
si tu connais la durée du trajet ta consommation est de ...?
Ok donc normalement on a :
800kg/m^3 = 0,8 kg/L
Eth = 5,4 * 0,8 * 50.10^3
Eth = 216 000 kj = 216 000 000 j
Soit le rendement = 6,48.10^5 / 216.10^6 = 3.10^-3 = 3 %
Je ne suis pas sur.
Lol en effet, bien vu.
Donc je trouve un résultat plus convenable avec un rendement de 30 %.
Merci encore Lamat, c'est très sympas ce que tu fais.


