Inscription / Connexion Nouveau Sujet
Calcul enthalpie de C3H4O l
Bonjour voici un énoncé :
L'acroléine de formule CH2=CH-CHO (C3H4O) est liquide à 300 K.
1-a. Calculer son enthalpie standard de formation à 300 K à partir de son enthalpie standard de combustion à cette température.
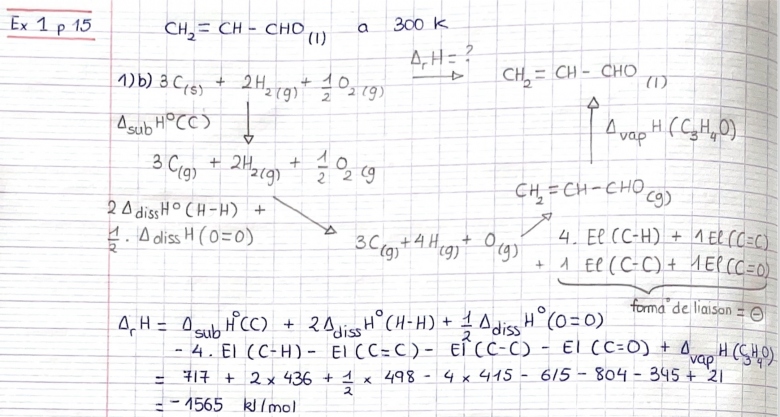
1-b. Déterminer l'enthalpie de formation de C3H4O liq à partir des valeurs des énergies deliaison et de l'enthalpie de sublimation du graphite.
1-c. Expliquer pourquoi les résultats obtenus aux questions 1-a et 1-b ne sont pas identiques.
Données : ∆combH° (C3H4O) = - 1629 kJ.mol-1, ∆vapH° (C3H4O) = + 21 kJ.mol-1
∆subH° (graphite) = + 717 kJ.mol-1
Mes réponses
1.a. D'abord j'ai écris l'equation de combustion :
C3H4O(l) + 7/2 O2(g) —> 3CO2(g) + 2H2O (l)
Ensuite on applique la loi de Hess :
 fH(C3H4O)l = 2
fH(C3H4O)l = 2 fH(H2O)l + 3
fH(H2O)l + 3 fH(CO2)g -
fH(CO2)g -  cH
cH
= 2*-285 + 3*-395 +1629
=-126 kJ/mol
1.b. Img cycle thermo
Et j'ai trouvé -1565 kJ/mol
1.c Je ne sais pas pourquoi il y a autant de difference entre les deux valeurs
Merci pour votre aide
Bonjour
Je crois que tu mélanges deux choses :
1. Le calcul d'une enthalpie standard de réaction en fonction des enthalpie standard de formation des produits et des réactifs. Il te faut donc pour cette méthode commencer par écrire l'équation de la combustion.
2. La détermination d'une enthalpie standard de formation à partir des énergies de liaisons qui utilise la méthode de Hess et que j'ai déjà eu l'occasion de t'expliquer.
OK. L'origine nulle des enthalpies standard est choisie de sorte que toutes les enthalpies standard de formation des corps simples stables (un seul type d'éléments chimiques) est nulle. L'enthalpie standard de formation du dioxygène est ainsi nulle. L'enthalpie standard de combustion s'écrit :
Bonjour,
Désolé de mon intrusion : juste une remarque, il manque un facteur 3 pour la sublimation ce qui conduit à -131 proche de -126.
Désolé de mon intrusion
 ;)
;)
Dans le second calcul, il faut faire intervenir 3 moles de carbone donc faire intervenir trois fois l'enthalpie molaire de sublimation du carbone. On obtient alors des résultats proches.
Questions : de ces deux valeurs, laquelle te semble la plus fiable ? comment expliquer la différence ? (Je t'ai fourni un élément de réponse dans un message précédent)