Inscription / Connexion Nouveau Sujet
Calcul de travail en thermodynamique
Bonjour,
En travaillant des exercices de thermodynamique, j'ai trouvé des difficultés concernant le calcul de travail. Je pense que ces difficultés résultent d'une incompréhension de cette notion.
Je donne deux exemples pour mettre en évidence mon problème :
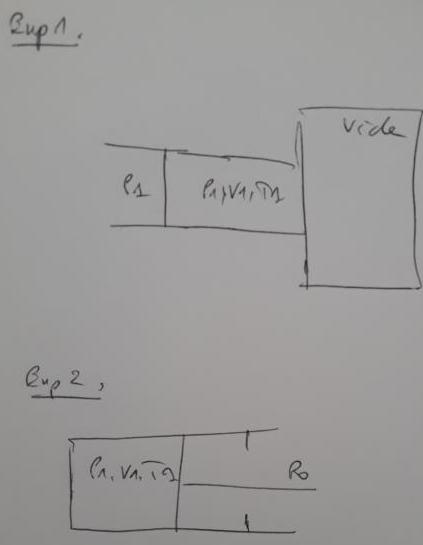
Exemple 1 : On considère le dispositif de la figure, où un gaz dans l'état P1, V1, T1 est en équilibre avec l'extérieur par l'intermédiaire d'une paroi mobile. La pression extérieure sera supposée constante et égale à P1 durant la transformation. On perce un petit trou dans la paroi donnant dans l'enceinte vide et le gaz diffuse lentement dans celli-ci en entrainant la paroi mobile. A la fin de la transformation la paroi mobile vient se coller à la paroi de l'enceinte. Calculer le travail reçu par le gaz lorsque la diffusion est terminée .
---> Pour ma part, j'ai essayé d'appliquer la relation du cours. Puisque le gaz était à un volume V1 et il est devenu à un volume V , donc W=-P1(V-V1) , ( P1 constante ) , or ce qui est correct est W=P1V1 car le travail est exercé par une pression P1 qui pousse sur un volume V1 .
Exemple 2 : On fait subir à un gaz parfait une détente de V1 à 2V1. L'opérateur effectue une détente isotherme réversible du gaz. Donner l'expression du travail W que reçoit le gaz.
---> Si on essaye d'appliquer le même concept qu'avant : on a l'opérateur et l'atmosphère de pression P=P0+Popérateur=Pgaz ( car détente réversible ) retranchent un volume V1 ( 2V1-V1 ) et on aurai W=-Pgaz.V1 (néfatif car c'est un travail fournit), or ce n'est pas correct, mais ce n'est qu'en appliquant la formule du cours (avec l'intégrale) qu'on obtient la bonne réponse.
J'espère que vous pourrez m'aider afin de comprendre la diffèrence entre les deux exemples et cette notion très importante en physique.
Merci d'avance,
Bonjour
Petite question préliminaire si tu permets :
Pour qu'il y ait travail, il faut qu'il y ait à la fois force exercée et déplacement (pas n'importe comment ce déplacement...)
As-tu bien compris ce que représente le travail élémentaire :  W=-Pext.dV ?
W=-Pext.dV ?
Quelle force ? quel déplacement ?
La réponse à ces questions devrait t'aider à résoudre tes problèmes...
Bonjour,
J'essaie de répondre à ces questions : Le travail élémentaire est : donc il dépend du déplacement élémentare de la force
. Donc dans :
on parle des forces extérieures au système étudié et qui appliquent une pression
sur celui , et de leurs déplacement élémentaires.
Je comprend la relation de l'exemple 1 : On a la force donc :
or le déplacement effectué par la force se fait de la position initiale ( comme sur la figure ) jusqu'à ce qu'elle se colle sur la paroi on a donc bien l'intégrale de S.dx qui est égal à V1
Et pour le deuxième exemple on a ceci : on a la force appliquée par l'atmosphère et la force appliquée par l'opérateur, seulement pour cette dernière on ne connait pas la pression exercée , pour cela on considérera la force somme des deux car comme la transformation est réversible on pourra dire que la pression extérieure ( l'extérieur ici est l'atmosphère et l'opérateur ) est égale à la pression du système , et en intégrant le et en tenant compte du déplacement des deux forces ( qui est
) on a le bon résultat.
Je comprends maintenant ^^
Merci énormément pour votre réponse ^^


