Inscription / Connexion Nouveau Sujet
Calcul de solubilité
Bonsoir,
Je recherche la solubilité de l'hydroxyapatite à 37° dans une solution de pH fixé à 7,2. L'équation de la dissolution est : .
Sa constante d'équilibre est Ks1=117. On suppose que dans l'état initial, il n'y a ni phosphate, ni calcium.
A moins de m'être trompé, je tombe sur une équation en x (avancement) qui est la suivante : , soit une équation de degré 3. Ce qui me chiffonne, c'est que c'est un sujet de concours que je suis sensé faire sans calculatrice, et je me retrouve à devoir calculer une racine cubique de tête. Je pense donc qu'il y a un problème, mais je ne vois pas où. Pourriez vous m'aider svp ?
Merci d'avance
Salut  !
!
As-tu des valeurs d'enthalpies libres (standards)?
Dans ce cas tu aurais ceci (désolé en géol on ne multiplies pas par 2 les coefficients...):
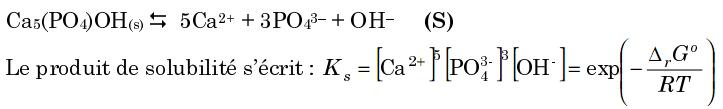
Non, je n'ai aucune valeur d'enthalpie libre, mais la finalité étant de trouver la solubilité, je ne vois pas comment j'aurai pu y arriver avec l'expression en fonction de l'enthalpie libre ...
Sinon je vois que tu as un pH, donc tu peux utiliser les données suivantes :
H3PO4/H2PO4- pKa1=2,15
H2PO4-/HPO42- pKa2=7,2
HPO42-/PO43- pKa3=12,1
Si tu considères la dissolution de s mol.L-1 d'hydroxyapatite dans cette solution maintenue à pH = 7,2 par un tampon, tu auras alors 5s mol.L-1 d'ions calciums, 6s mol.L-1 de phosphate sous forme H2PO4- et HPO42- à cause de la valeur du pH, et enfin 2s d'ions hydroxydes.
A cette valeur de pH, tu as [H2PO4-] = [HPO32-] = 3s. Or tu connais le pH et tu as l'équilibre Ka3 donc tu obtiens la [PO43-] en fonction de s. Avec le pH tu connais le pOH et tu trouves [HO-] = 10-6,8 mol.L-1
Tu injectes dans Ks et tu en déduis s
Ta solution a l'air d'être la bonne, car en effet, ces couples étaient donnés.
Ce que je ne comprends pas, c'est pourquoi :
- dans la solution j'ai des H2PO4- et des HPO42-
- j'ai [H2PO4-]=[HPO42-
- j'ai l'équilibre Ka3
Si si c'est tout à fait possible de raisonner avec les enthalpies libres 
pH = pKa donc ça te permet d'écrire une équation de dissolution équivalente rendant compte de la formation d'autant d'H2PO4- que de HPO32-
J'insiste bien sur ce point et je te démontre ma première phrase (parce-que j'aime la thermochimie et que je pense que ça peut te servir vu ta question  )
)
Pas besoin de démontrer trop loin, dommage que je n'ai pas de valeurs à disposition, si j'en trouve dans mes bouquins de géol je te les mets de suite (mais ce sera à 25°C)
Tu obtiens cette relation assez facilement (tu auras compris l'abréviation HAP je pense)
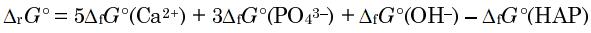
Or RTlnKs peut se mettre en rapport avec le log de Ks et tu obtiens facilement le pKs donc le Ks
Ensuite tu peux faire un joli pKD si t'as la valeur (pas trop compliqué lorsque tu connais pKs):
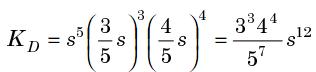
d'où tu extrais ce machin peu esthétique :
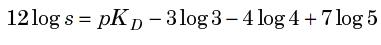
D'accord pour la thermochimie  , mais comme je dois travailler sans calculatrice, ça va pas être cool pour calculer tous ces log
, mais comme je dois travailler sans calculatrice, ça va pas être cool pour calculer tous ces log  .
.
Par contre je ne comprends toujours pas pourquoi je peux dire que comme on est à pH=7,2, je peux "substituer" le PO43- par les deux autres ions (et pourquoi j'ai aussi l'équilibre Ka3)
Alors désolé pour les posts successifs : avec des tableaux d'enthalpies libres
Pour  rG°(Ca2+) = -553 kJ/mol
rG°(Ca2+) = -553 kJ/mol
 rG°(HO-) = -237 kJ/mol
rG°(HO-) = -237 kJ/mol
 rG°(PO43-) = -1020 kJ/mol
rG°(PO43-) = -1020 kJ/mol
Et j'ai trouvé  rG°(HAP) = -6390 kJ/mol
rG°(HAP) = -6390 kJ/mol
Regarde les trois valeurs de pKa... Tu vois bien qu'il y a une valeur de pKa égale à 7,2. Et lorsque pH = pKa tu peux écrire un équilibre non? 
Tu peux faire le truc de thermochimie à titre indicatif, ça entraîne toujours 
ouais pardon, c'est un lapsus : y'a une coquille à 20h03 aussi, il manque un O dans une des espèces... mais les espèces à considérer sont celles-ci
j'interviens ... vous y etes presque
On appelle s la solubilité et on a le produit de solubilité 10^-117 ?
on a 10s de Ca2+ 3s de HPO42- et 3s de H2PO4- et 10^-6,8 de OH- . Avec Ka3 et le pH on calcule (PO4-) en fonction de s et on remet tout cela dans Ks et on evalue s


