Inscription / Connexion Nouveau Sujet
Calcul de pH avec nernst
Bonjour je révise pour un exam de chimie générale de L2 et je bloque sur un calcul de ph. (question 2)
On a vu ça au premier semestre mais j'ai déjà oublié des choses. Si vous pouviez m'aider ce serait vraiment cool.
Voici l'exo nommé "Quelques réactions de l'aluminium et de ses sels"
Expérience 1 : On prépare une solution limpide S1 en dissolvant n1 = 5.10-4 mole de sulfate d'aluminium(III)
Al2(SO4)3 dans V1 = 100 mL d'une solution très acide.
On ajoute ensuite progressivement une solution d'hydroxyde de sodium très concentrée de façon à pouvoir négliger la variation de volume due à cette
addition.
Il y a tout d'abord, alors que le pH est encore acide, apparition d'un précipité blanc laiteux ; on note pH1.
En poursuivant l'addition de la soude, on observe l'épaississement de ce précipité puis sa dissolution progressive ; le milieu est franchement basique lorsque le précipité disparaît ; on note pH'1.
Expérience 2 : Dans un récipient, on introduit m2 = 0,1 g de poudre d'aluminium et V2= 12 mL d'une solution d'acide chlorhydrique à c2 = 1 mol.L-1 puis on chauffe légèrement.
Il y a dégagement d'un gaz incolore qui se poursuit jusqu'à la disparition totale de la poudre métallique. La solution obtenue à la fin du dégagement est gazeuze est limpide. On vérifie que le volume de la solution limpide obtenue est encore V2 et on mesure pH2.
Expérience 3 : On recommence l'expérience précédente en remplaçant la solution acide par de la soude de même concentration. On observe le dégagement du même gaz incolore jusqu'à disparition de la poudre d'aluminium.
Le volume de la solution limpide S3 obtenue est encore V3 = V2 et on mesure pH3.
Expérience 4 : A la solution S3, on ajoute progressivement une solution concentrée d'acide chlorhydrique ...
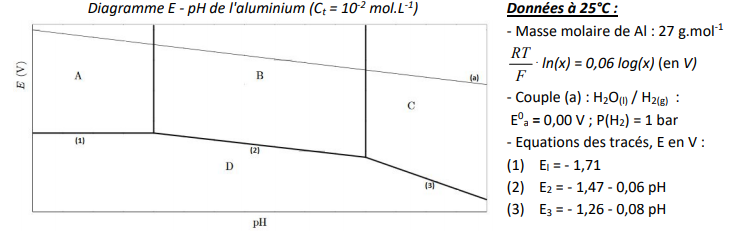
Pour interpréter ces expériences, on dispose de l'allure du diagramme E-pH de l'aluminium tracé pour une
concentration en aluminium dissous égale à 10-2 mol.L-1.
1) Indiquer sur le diagramme la correspondance entre les lettres A, B, C et D et les espèces intervenant dans le tracé : Al3+(aq), Al(OH)4-(aq), Al(s) et Al(OH)3(s).
1) Ecrire les équations équilibrées des réactions :
a) de précipitation puis de dissolution observées dans l'expérience 1.
b) de la poudre d'aluminium avec la solution d'acide chlorhydrique dans l'expérience 2.
c) de la poudre d'aluminium avec la solution d'hydroxyde de sodium dans l'expérience 3
2) Calculer les pH mentionnés dans les trois premières expériences.
3) Qu'observe-t-on dans l'expérience 4 ? Ecrire les équations des réactions successives.
Voir données supplémentaire en bas de page
Pour les réactions j'ai mis:
Exp 1: Al2(SO42-)3 = 2Al3+ + 3SO42-
Exp 2: 2 Al + 6H3O+ = 2Al+ + 6H20+ 3H2
Exp 3: Al3+ + 4OH- = Al(OH)4-
Exp 4: Al(OH)4- + H3O+ = Al(OH)3
Je reste en ligne pour répondre
Bonjour
Pour l'expérience 3, il faut écrire l'équation bilan de la réaction de la soude sur l'aluminium avec dégagement de H2 et formation de Al(OH)4-
Pour l'expérience 4 : il y a dans une première étape formation du précipité par la réaction que tu as écrite puis, si on continue à ajouter de l'acide pour faire diminuer le pH en dessous du pH de la frontière entre les domaines A et B, il y a redissolution du précipité avec formation de Al3+.
Que proposes-tu pour les calculs de pH demandés ?
*J'ai fait une erreur de frappe pour la 2 ca donne bien Al3+
Pour la 3 effectivement il y a une grosse erreur mais je ne vois pas...
3 fois { 2H2O +2e- = H2 +2HO- } réduction
2 fois { Al + 4HO- = Al(OH)4-+ 3e- } oxydation
2Al + 2 HO- +6H2O= 2Al(OH)4- + 3H2.(4)
Tu peux le faire en combinant l'équation bilan obtenue avec l'équation de l'autoprotolyse de l'eau mais pourquoi faire cela alors que l'énoncé précise bien que la réaction se produit par réaction de la poudre d'aluminium sur une solution assez concentrée de soude ? Il est donc logique d'écrire l'équation bilan en faisant intervenir les ions hydroxyde comme il est logique de faire intervenir les ions oxonium lors de la réaction de la poudre d'aluminium sur un acide fort.
Je suis perdu, à quoi correspond?
(1) El = - 1,71
(2) E2 = - 1,47 - 0,06 pH
(3) E3 = - 1,26 - 0,08 pH


