Inscription / Connexion Nouveau Sujet
Bilan Energétique
Bonsoir !
Je bloque sur la calorimètrie.
Mon objectif est de déterminer la masse en eau que l'on appellera u (masse d'eau fictive qui aurait la même capacité thermique que le calorimètre).
Pour ce faire, je dois déterminer le bilan énergitique relatif à mon expérience et qui me permmettra justement u?
Le problème est que je ne sais pas comment m'y prendre.
D'après ce que j'ai pu lire sur Internet:
Q(réaction) = Q(chaleur dégagée)
Voici les grandes lignes du protocole:
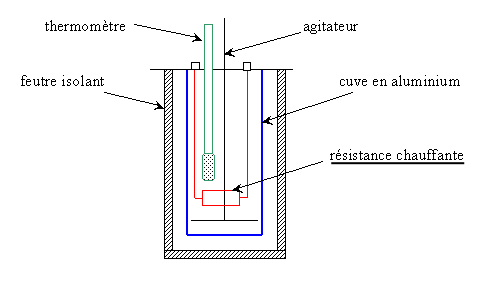
On place dans le calorimètre une quantité d'eau de masse m1 (stabilisé à une température t1). Puis on chauffe grâce à une résistance R alimenté par un courant I. Il en résulte une augmentation de température.
On considère le calorimètre sans échange de chaleur avec l'extérieur (adiabatique)
Déjà logiquement, avec la présence de la Résistance, il y aura un effet joule. (je sais que P=R*I²)
Après, il y aura l'énergie relative au calorimétre dont je ne connais pas l'expression.
Pouvez vous m'aider à poursuivre et à déterminer u ?
Merci
Bonsoir,
Pour le calorimètre :
W1 = (m1 + u) ceau (T2 - T1)
Pour l'énergie fournie par la résistance :
W2 = R I2 t (t étant le temps de chauffage en secondes)
Et on a, bien sûr :
W1 = W2
Bonsoir
et merci de votre réponse.
Je voulais juste vous demander pourquoi on pouvait affirmer que W1=W2 ? Cela voudrait dire que toutes l'énergie de la résistance est transférée au calorimètre sans aucune perte. En pratique, c'est faux, non ?
Merci
Bonsoir, une petite question m'est encore venu à propos de la calorimétrie.
La capacité thermique de l'eau est elle la même a des températures et masses différentes de l'eau ?
Merci
Je voulais juste vous demander pourquoi on pouvait affirmer que W1=W2 ?
Parce qu'on dit dans l'énoncé : "On considère le calorimètre sans échange de chaleur avec l'extérieur".
Donc toute la chaleur produite est récupérée par l'eau.
En pratique, c'est faux, bien entendu.
En fonction de la masse, la capacité calorifique ou thermique (ou chaleur massique) ne varie pas mais elle varie un peu en fonction de la température.
température(°C) chaleur massique (J/g·K)
0 4,2176
10 4,1921
20 4,1818
30 4,1784
40 4,1785
50 4,1806
60 4,1843
70 4,1895
80 4,1963
90 4,2050
100 4,2159
Bonjour,
j'ai utilisé la formule que vous avez établi dans la suite de mon exercice mais cependant je trouve une incohérence. Je pense que la formule est juste mais que c'est plutôt moi qui me suis trompé dans un des calculs. Pouvez vous m'aider ?
Donner l'intensité qui devra traverser la résistance R (10 ohms) pour élever la température de m=300g d'eau de 10 °c en 5mn.
La puissance dissipée par le résistance ne doit pas dépasser Pmax=50W
Je n'arrive pas à remplir la dernière condition.
Pourtant j'ai fait attention aux unités.
J'ai utilisé la formule que vous m'avez expliqué.
Grandeurs:
c=4180 J/kg/K
J'ai posé m=m1+u=0.3 kg
R= 10 Ohms
t2-t1=10°C=283.15 K
t=5mn=300s
Or
Pour calculer la puissance
P=R*I²=10*100=1000 W
Je trouve que 1000 W est vraiment très élevé et très éloigné des 50 W.
Merci
D'accord, merci pour vos précisions.
Justement, n'y a t-il pas un problème avec l'énoncé: "sans échange de chaleur avec l'extérieur". La résistance n'est pas interne au calorimètre, c'est bien un élément extérieur, non ?
Merci
Non, sans échange de chaleur avec l'extérieur, c'est presque vrai.
Un calorimètre est construit en général comme un vase de Dewar c'est-à-dire qu'il y a une double paroi avec le vide entre les deux. C'est comme un thermos si tu préfères... D'ailleurs, tu peux utiliser un thermos comme calorimètre (regarde comment est fait un thermos (inutile de le casser, tu regardes à l'intérieur, c'est suffisant)) . On n'a pas obligatoirement le vide entre les deux parois dans un calorimètre : on peut avoir une isolation thermique mais c'est moins bien.
L'équivalent en eau du calorimètre est la chaleur absorbée par la paroi intérieure du calorimètre. On a inventé cette notion de "valeur en eau du calorimètre" ou "masse équivalente en eau du calorimètre" pour simplifier les calculs. C'est la masse d'eau qui absorberait la même quantité de chaleur que la paroi du calorimètre. Il faut l'ajouter à la masse réelle d'eau à chaque fois.
La résistance n'est pas interne au calorimètre, c'est bien un élément extérieur, non ?
Non, la résistance est certainement à l'intérieur du calorimètre sinon il y aurait des problèmes de transfert de chaleur...