Inscription / Connexion Nouveau Sujet
avancement thermochimie
Bonjour,
Je suis en train de faire un exercice de thermochimie et je ne comprends pas comment calculer l'avancement puisqu'on a pas d'informations sur le nombre de moles initial et sur la pression. Dans la correction, il y a écrit que l'avancement est de 1 mole mais je ne vois pas d'où ça vient. Voici l'énoncé de l'exercice en question :
Actuellement, la synthèse industrielle du méthanol se fait par réaction du gaz à l'eau (mélange de monoxyde de carbone et de dihydrogène obtenu par gazéification du coke en présence de vapeur d'eau) sur des catalyseurs à base de cuivre chauffés vers 300°C.
A 298K, l'équation bilan de la réaction s'écrit :
CO(g)+2H2(g)  CH3OH(l)
CH3OH(l)
Données :
Enthalpie standard de formation (kJ/mol) à 298K : CO(g): -110,5; CH3OH(l) : -238,7
Enthalpie standard de vaporisation du méthanol à Téb = 362,7K :  vapH°CH[sub]3OH[/sub]=35,3kJ/mol
vapH°CH[sub]3OH[/sub]=35,3kJ/mol
Capacités calorifiques molaires à pression constante (indépendantes de la température):
| Composé | CO(g) | H2(g) | CH3OH(l) | CH3OH(g) |
| C°p,m(J/K/mol) | 29,1 | 28,8 | 81,6 | 43,9 |
Merci d'avance pour votre aide !
Bonjour
Comme d'habitude, sans énoncé complet...
Peut-être s'agit il de partir d'une mole de CO et 2mol de H2 et de trouver l'avancement à l'équilibre à 300°C. Tu auras ainsi le taux de conversion du CO en méthanol. Pour cela, en appliquant les lois de Kirchoff, tu peux déterminer l'enthalpie et l'entropie standard de réaction à 300°C. Tu en deduiras l'enthalpie libre standard de réaction puis la constante d'équilibre de la réaction à 300 °C...
Bonjour,
Mon énoncé est complet. Je n'ai pas mis les questions qui étaient posées car il n'y avait pas de rapport avec ma question initiale. Les voici :
1. Calculer l'enthalpie standard de réaction à 298K.
2. Ecrire la réaction de synthèse de méthanol à 300°C.
3. Construire un cycle thermodynamique à pression constante faisant intervenir les réactions de synthèse du méthanol à 25°C et 300°C.
4. Faire un bilan enthalpique et en déduire l'enthalpie standard de réaction à 300°C.
Je ne pense pas qu'il y ait un indice utile dans les questions permettant de trouver l'avancement mais je peux me tromper. Mon prof a peut-être oublié d'indiquer les quantités molaires initiales.
Merci de ces précisions. Elles ne font que confirmer mon message précédent. Il s'agit de déterminer la constante d'équilibre à 300°C puis le taux de conversion du CO en méthanol. La seule information manquante est la suivante : le mélange initial CO - H2 est-il stoechiometrique comme je l'ai supposé ?
Je ne sais pas, ce n'est pas indiqué dans l'exercice, j'ai donné toutes les informations indiquées. Je ne comprends pas comment on peut déterminer la constante d'équilibre vu qu'on a pas d'information sur les pressions et qu'on ne sait pas combien vaut l'entropie standard des composés.
J'espère que tu ne confonds pas constante d'équilibre et quotient de réaction. La constante de réaction est fournie par la relation :
Les données thermodynamiques fournies permettent de déterminer ainsi la constante d'équilibre à 300°C comme expliqué dans mes précédents messages.
Le quotient de réaction fait intervenir les activités des produits et des réactifs. A 300°C, les trois constituants sont gazeux. Chaque activité est le quotient de sa pression partielle sur P°=1bar (pression standard de référence). Cela donne ici :
P désigne la pression totale, les "x" désignent les fractions molaires.
La confusion est parfois entretenue par le fait que l'on étudie presque toujours des situations d'équilibre pour lesquelles la constante d'équilibre est égale au quotient de réaction.
Mais à l'équilibre on a bien K°(300°C)=Qréq ?
Ici, je ne vois pas comment déterminer K° étant donné qu'on ne connaît pas les pressions et les fractions molaires à l'équilibre ni  rS°. Comment faut-il donc procéder ?
rS°. Comment faut-il donc procéder ?
Les seule questions de l'énoncé que tu as copiées consistent à déterminer l'enthalpie standard de réaction à 298K puis la même grandeur à 300°C. Nous avons un peu extrapolé la suite. Commence donc déjà par cela en appliquant la loi de Kirchhoff.
J'ai déjà répondu aux questions posées par l'énoncé. Ce qui me pose problème, c'est que pour la dernière, il faut connaître l'avancement de la réaction et je ne vois pas comment l'obtenir. Dans la correction, il y a écrit que l'avancement est de 1 mole mais je ne vois pas comment on le trouve.
Pour obtenir  rH° à 300°C en fonction de
rH° à 300°C en fonction de  rH° à 25°C que tu obtiens à partir des données, il faut faire un bilan enthalpique comme demandé par l'énoncé et utiliser le fait que l'enthalpie est une fonction d'état. La quantité de matière prise en compte pour ce bilan peut être quelconque. Le plus simple consiste à choisir une mole de CO, 2moles de H2 pour aboutir à une mole d'alcool, ce qui revient effectivement à imaginer un avancement d'une mole.
rH° à 25°C que tu obtiens à partir des données, il faut faire un bilan enthalpique comme demandé par l'énoncé et utiliser le fait que l'enthalpie est une fonction d'état. La quantité de matière prise en compte pour ce bilan peut être quelconque. Le plus simple consiste à choisir une mole de CO, 2moles de H2 pour aboutir à une mole d'alcool, ce qui revient effectivement à imaginer un avancement d'une mole.
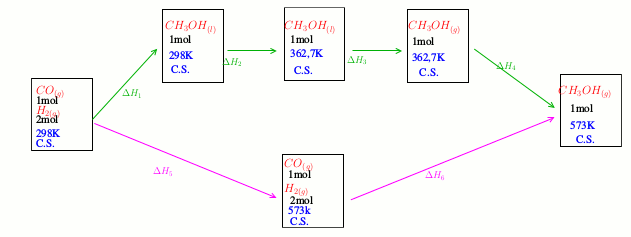
Bonjour
Voici un schéma illustrant un bilan enthalpique permettant d'obtenir l'enthalpie libre standard de réaction à 300°C. Partant de 1mole de CO et 2moles de H2 dans les conditions standard (C.S.) à 25°C, on passe à une mole de méthanaol à l'état gazeux à 300°C par deux "chemins" différents. L'enthalpie étant une fonction d'état :
Chacune de ces variations d'enthalpie s'exprime en fonction de données de l'énoncé ou de  rH°(298) ou de
rH°(298) ou de  rH°(573).
rH°(573).