Inscription / Connexion Nouveau Sujet
Atomistique case quantique
Bonjour,
j'envoi ce message car même si j'ai globalement compris la règle de Klechkowski pour trouver la configuration électronique d'un atome, je n'ai pas compris comment remplir les cases quantiques.
Quelqu'un pourrait-il m'expliquer le principe dans le cas concret de cet exercice corrigé svp?
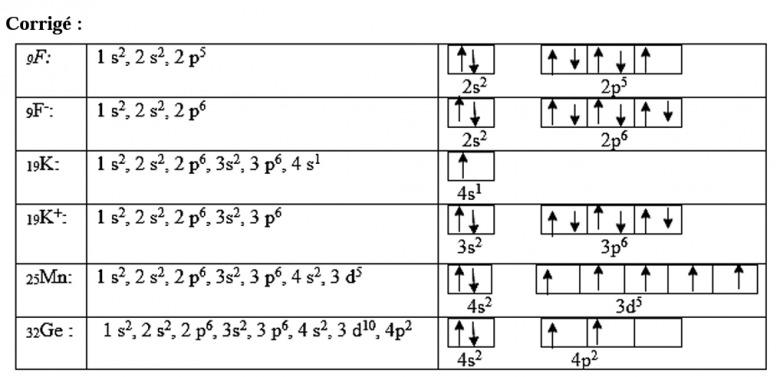
Par exemple si je prend l'atome de Fluor de cet exercice corrigé , je comprend comment trouver la configuration électronique, et pour les cases quantique le remplissage des cases(orbitales), la flèche vers le haut c'est le spin+1/2 de l'électron, ça ça va.
Mais pourquoi on ne fait pas la même chose pour le manganèse( Mn, Z=25)?
La 3d est a moitié rempli ce qui rend l'orbitale plus stable mais ces flèches j'y comprend pas grands chose.
J'ai essayé de comprendre le principe de Pauli mais bof.
Bonsoir
Même si l'énoncé du principe de Pauli, dans sa généralité, peut paraître compliqué, sa conséquence en atomistique est simple et peut se résumer par : "pas plus de deux électrons par orbitale atomique, donc par case quantique".
Sinon, je crois que tu n'as pas compris la règle de Hund. Lorsque un niveau d'énergie n'est pas complètement rempli, les électrons se répartissent de façon à occuper un maximum d'orbitales atomiques (de cases quantiques) avec un maximum de spins identiques. Cela est utile ici pour Mn et Ge.
Bonjour,
Ah ok! pas plus de deux électrons ou "flèches" par case quantique.
Oui j'avais pas compris la règle de hund.
J'allais te poser une question "bidon" en demandant pourquoi pour le Fluor on n'a pas 5 case quantiques avec une flèche vers le haut,mais c'est la sous couche 2p6 donc il y a au max 3 case quantique tu es un bon pédagogue merci!
Ma seule difficultée sera de trouver les électrons de valences(ils sont à la fin), mais parfois on dirait que c'est du cas par cas.
parfois c'est 4s2 4p2 ,puis parfois 4s2 3d5 suivant l'atome...
Les électrons de valence sont les électrons d'énergie égale ou supérieure à celle des électrons nmaxs2.
Exemples :
Mn : nmax=4 : les électrons de valence sont les 2 électrons 4s et les 5 électrons 3d.
Ge : nmax=4 : les électrons de valence sont les 2 électrons 4s, les 10 électrons 3d et les 2 électrons 4p
A noter que le nombre d'électrons de valence est égal au numéro de la colonne du tableau périodique dans laquelle se trouve l'élément chimique.
D'accord, merci , c'est déjà plus clair.
Sinon j'ai aussi trouvé cette loi :
La loi de couche de valence : le n le plus élevé + le d qui contiens moins de 10 électrons
Source:
http://www.chimiegenerale.com/couche_de_valence.php
Attention quand même : les électrons p ?
La définition que tu as trouvée n'est pas assez générale et il faut tenir compte si nécessaire des électrons d même si le niveau d est complet à 10 électrons.
En fait on rempli nos sous couches correctement, on écrit le remplissage dans l'ordre de gauche à droite, on repère le 1er n le + élevé, et tout ce qui est à droite est dans la couche de valence.
C'est ça ?
Par contre je trouve souvent des énoncés où on donne par exemple "cuivre : [Ar] 3d10 4s1", alors qu'on remplit d'abord la sous couche 4s (et les 11 électrons ici font bien parti de la couche de valence).
Je pense que c'est de là que vient la règle qu'il a trouvé (la plupart des exceptions rencontrées étant entre sous couche s et d), et moi aussi j'avais cette impression que y'avait pleins d'exceptions à cause de ce genre de mauvaise notation  . Mais effectivement, la règle reste fausse ou très mal formulée/contextualisée.
. Mais effectivement, la règle reste fausse ou très mal formulée/contextualisée.
C'est ça ?
Oui à condition de bien respecter la règle de Klechkowski, ce que fait le document fourni parJean469 lorsqu'il écrit les structures complètes mais ce qu'il ne fait pas lorsqu'il considère les cases quantiques.
Il est exact que remplir complètement un niveau d ou le remplir à moitié (en d5) apporte un supplément de symétrie aux orbitales d , ce qui les stabilise. Cela entraîne une exception à la règle de Klechkowski. Cela justifie une écriture de la forme "cuivre : [Ar] 3d10 4s1" plutôt que [Ar]4s2 3d9 mais cela ne justifie pas d'exclure les 10 électrons d de la couche de valence.
Personnellement, je conseille une description complète de la couche de valence en incluant les orbitales atomiques de cette couche lorsqu'elles sont vides à l'état stable, ce qui donne pour l'élément cuivre : 3d10 4s1 4p0 car ces orbitales atomiques peuvent intervenir dans certaines hybridations ou dans la formation de complexes.


