Inscription / Connexion Nouveau Sujet
Ajout de solution PH
Bonjour, bonsoir ,
Une petite question: si on ajoute 200ml d'une solution de NaOH a 0.4 mol.L , a une solution A qui contient 500ml de 0.2 mol de HCOOH et 0.1 mol de NaHCOO quel est le PH de la solution final ?
Pour trouver le PH faut -il faire comme celà ?
Solution A = (0.5*0.2)=0.1 mol de HCOOH ET (0.1*0.5)= 0.05 mol de NaHCOO
Donc si on ajoute 200 ml de NaOH soit (0.2*0.4)=0.08 mol de NaOH
Du coup on fait un tableau d'avancement basique et on remplace Ksi par 0.08 et apres ph=pka+log(BASE/ACIDE) ??
Le problème c'est que je me trompe quelque part mais je ne vois pas ou...
Merci infiniment 
Bonsoir,
méthode possible :
1 identifier la réaction prédominante
2 vérifier qu'elle est quasi totale
3 remplir un tableau d'avancement
4 utiliser la formule que tu as rappelée dans ton message.
Si tout va bien, tu devrais arriver à pH  4,6
4,6
Merci Vanoise j'ai reussi a trouver le bon PH grâce a toi 
Mais comme un problème arrive jamais seul ...
question 2 : meme question sauf que cette fois si on ajoute 0.5L de NaOH a 0.4 mol.L
à la solution A toujours .
et la CATAstrophe car je trouve des quantités négatives ...
Bonjour,
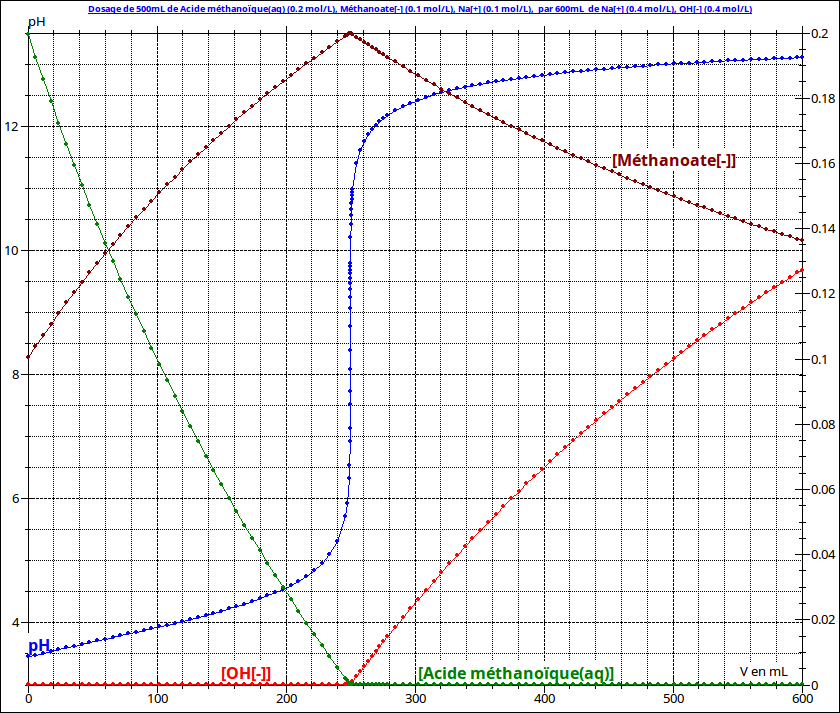
La réaction que tu as envisagée est terminée ! Le pH est imposée par la soude ajoutée après l'équivalence ; elle reste en solution et impose son pH. J'espère que les courbes ci-dessous t'aiderons à comprendre. Il s'agit de l'évolution en fonction du volume de soude ajouté, du pH de la solution et des concentrations. Intéresse-toi en particulier à l'évolution de la concentration en ions hydroxyde. Tu devrais obtenir pH 13.
13.
Bonjour et encore merci de me répondre  ,
,
Du coup la soude impose le PH ? si j'ai bien compris il suffit juste de faire la formule ph =14+logC ?
si j'ai bien compris il suffit juste de faire la formule ph =14+logC ?
Il faut d'abord réfléchir au lieu d'appliquer une formule qui n'est pas nécessairement adaptée.
Commence par te demander quelle est la quantité de soude ajoutée après l'équivalence, ce qui demande de calculer d'abord le volume de soude ajoutée à l'équivalence.
De la quantité de soude ajoutée après l'équivalence et du volume de la solution, tu déduiras la concentration en ions hydroxyde et, seulement là : tu pourra appliquer ta formule !


