Inscription / Connexion Nouveau Sujet
Addition
 etudiantilois
etudiantiloisBonsoir,
J'ai du mal à percevoir la différence entre l'addition électrophile et l'addition nucléophile.
Est-ce que quelqu'un pourrait m'expliquer svp ? Et dans quels cas rencontre-t-on l'un et l'autre ?
Merci beaucoup par avance pour l'aide et bonne année !
Bonsoir etudiantilois,
Quelques définitions pour commencer.
Electrophile : un composé chimique déficient en électrons.
Ce sont des donc des espèces potentiellement chargée positivement (ex: H+), mais pas seulement.
Nucleophile : un composé chimique excédentaire en électrons.
C'est donc une espèce qui va chercher à partager des électrons.
Typiquement, une anion (HO-, Br-, etc.) ou une atome avec des doublets non liants (ex: l'oxygène d'une cétone).
Remarque : Les nucleophile sont des bases de Bronsted (donneur d'électrons).
Remarque : Les nucleophile sont des bases de Lewis (donneur d'électrons).
mmalou edit 
Addition électrophile :
Comme son nom l'indique on vient greffer un substituant déficitaire en électrons (électrophile) sur un substrat riche en électrons (qui sera donc nucleophile).
Substrat classique:
Les composés insaturés (alcène, alcyne, etc.). Les insturations sont riches en électrons.
Groupes additionnés classiques:
- de l'eau (hydratation)
- un halogènure d'hydrogène HX (hydrohalogenisation)
- un dihalogène X2 (dihalogenisation)
A chaque fois, la molécule (A-B) que l'on souhaite ajouter contient un morceau électrophile (qui se fera attaquer par le substrat riche en électrons à greffer) et un morceau nucleophile (qui interviendra après l'ajout du morceau électrophile).
Si on appelle A, le morceau électrophile.
Le substrat riche en électrons attaque A et forme un carbo-cation.
Le carbo-cation étant déficitaire en électrictrons, il est donc électrophile. Ça tombe bien, car le morceau B est justement riche en électrons et va donc pouvoir attaquer ce carbo-cation.
Te rappelles tu des règles pour savoir quel carbo-cation se formera ?
Te souviens-tu de la différence de mécanisme dans le cas d'une dihalogenation ?
Addition nucleophile :
Comme son nom l'indique on vient greffer un substituant riche en électrons (nucleophile) sur un substrat pauvre en électrons (qui sera donc électrophile).
Substrat typique: Les carbonyles (cétones, aldéhydes...).
la liaison C=O est polarisée.
L'oxygène étant plus électronegatif que le carbone, il tire d'avantage les électrons de son côté. Ainsi le carbone se trouve appauvrit en électrons.
On mettra  + sur le carbone et
+ sur le carbone et  - sur l'oxygène.
- sur l'oxygène.
Bref ! Le carbone du carbonyle est une cible de choix pour une addition nucléophile.
Les nucléophiles les plus communs sont :
- eau (formation de diol)
- alcool (protection des carbonyle en hemi-cetal ou acétal)
- amine R-NH2 (formation d'imine)
- les organomagnésiens (le groupe alkyle est particulièrement riche en électrons, c'est d'ailleurs une des rares méthodes d'obtenir un carbone  -)
-)
- Toute de phosphore (réaction de Wittig?)
Te souviens-tu des mécanismes de ces réactions ?
Te rappelles tu des règles pour savoir quel carbo-cation se formera ?
Oui, c'est le plus stabilisé, donc le plus substitué et qui possède éventuellement des effets électrodonneurs ?
Te souviens-tu de la différence de mécanisme dans le cas d'une dihalogenation ?
Là par contre, non...
Un immense merci pour votre aide !
Et pensez-vous pouvoir répondre à mon sujet "Vocabulaire Chimie" ? Ce serait formidable...
En résumé, les réactions d'additions se font sur des molécules insaturées.
Addition électrophile :
Les alcènes et alcynes sont propices aux additions électrophile. Le mécanisme se fait en 2 temps, avec formation de carbocation.
Addition nucléophile :
Si l'instauration est polarisée (ex: liaison C=O), attend-toi à une addition nucléophiles. Le carbone (déficitaire en e-) se fera attaqué par un atome riche en électrons.
Remarque : Oxygène et Souffre sont dans la même colonne du tableau périodique. Leur réactivité est donc similaire. Ainsi, une liaison C=S sera polarisé dans le même sens que C=O.
Est-ce un peu plus clair ?
Metal Oxalate
Citation :
Te rappelles tu des règles pour savoir quel carbo-cation se formera ?
Oui, c'est le plus stabilisé, donc le plus substitué et qui possède éventuellement des effets électrodonneurs ?
Oui, très bien ! C'est exactement ça
 !
!
Citation :
Te souviens-tu de la différence de mécanisme dans le cas d'une dihalogenation ?
Là par contre, non...
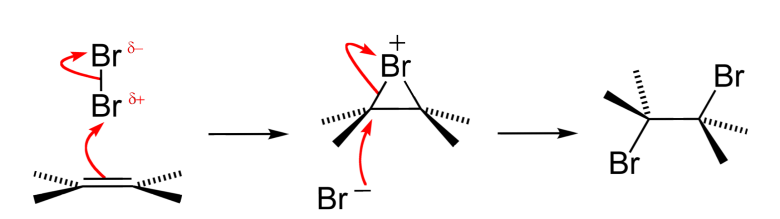
En fait, dans le cas des dihalogène, on ne forme pas de carbo-cation mais un pont (on parle d'halonium ponté).
Explications : Les halogènes sont particulièrement riches en e-, et possèdent 3 doublet non liants...
Ainsi, même si X-X se scinde en un X
 + (électrophile) et un X
+ (électrophile) et un X  - (nucléophile): une fois le X
- (nucléophile): une fois le X  + greffé, un de ses doublets non liants va attaquer le carbone qui aurait dû porter le carbo-cation.
+ greffé, un de ses doublets non liants va attaquer le carbone qui aurait dû porter le carbo-cation.
Puis le 2eme X vient attaquer la molécule, pour former le dihalogène. Le 2eme X attaquera bien sûr le carbone le plus électrophile, c'est à dire le plus substitué.
Merci beaucoup MetalOxalate pour toutes ces explications !
Je vais les lire demain à tête reposée, je vous dirai si j'ai bien compris.
En attendant, pourriez-vous regarder mon autre post de chimie organique "Vocabulaire
Chimie" ?
Je vous en serais très reconnaissant. D'avance, merci ! 
Bonsoir MetalOxalate
Juste pour signaler ce qui n'est certainement qu'une étourderie :
Remarque : Les nucleophile sont des bases de Bronsted (donneur d'électrons).
Il faut lire "Lewis " plutôt que "Bronsted".
À charge de revanche car au niveau des étourderies , je me débrouille assez bien !



