Inscription / Connexion Nouveau Sujet
acide/base
bonjour besoin d'aide svp
On dispose des solutions acqueuse suivantes
solution A: acide formique(HCOOH),C1=0,4M et KA1=;
solution B: acide acétique(CH3COOH),C2=0.4M et KA2=
1)calculer le ph de chacune des solutions A et B
2)On melange 100mL de A et 100mL de B
calculer le pH de la solution D ainsi preparée
3)On ajoute à la solution D 3,8g de NaOH ,en neggligeant les variation de volume.calculer le pH de la solution E ainsi obtenue.
4)quel serai le pH si on avait ajouté seulement 1,6g de NaOH à la solution D?Quelles seraient les concentrations molaire de CH3COONa formés
je suis bloqué à la 3eme question ...
***Si tu es bloqué à la troisième question, tu pourrais au moins expliquer ce que tu as fait pour les questions 1 et 2***
pour la 1) comme on a un monoacide faible pha==2.07
de la même manière phb==2.57
pour la 2) on a un melange de deux acide faible donc
pHD==2.20 avec C'1 et C'2 les nouvelles concentrations
Bonjour
J'espère que tu as vérifiée la pertinence des hypothèses simplificatrices qui conduisent aux formules que tu as appliquées.
Pour la suite :
Quelles sont les réactions prépondérantes ? Peuvent-elles être considérées comme totales ?
Calcule les quantités introduites de chacun des trois réactifs puis réfléchis ; la chimie ne consiste pas à appliquer des formules toutes faites...
J'espère que tu as vérifiée la pertinence des hypothèses simplificatrices qui conduisent aux formules que tu as appliquées.
sinon j'ai trouvé 0,08 mol de NaOH et 0,04 mol de HCOOH et CH3COOH
mon probleme c'est que pour moi 0,04 mol de NaOH vont reagir avec les 0,04 mol de HCOOH et les 0,04 mol restant avec CH3COOH donc normalement il ya equilibre des bases et de l'acide je pense donc pH=7?(je pense avoir faux enfaites)
vous demandez si je connais la demonstration des formules ?
Cela serait bien effectivement de les connaître mais je ne t'en demandais pas tant : il me parait indispensable de connaître les conditions de validités précises de chaque formule. Par exemple : la première que tu utilises suppose l'autoprotolyse de l'eau d'influence négligeable donc pH<6,5 pour une solution acide et suppose que l'acide faible a très peu réagi sur l'eau, ce qui suppose pH<(pKa-1)...
sinon j'ai trouvé 0,08 mol de NaOH
La masse molaire de l'hydroxyde de sodium étant égale à 40g/mol, 3,8g de ce produit pur ne représente pas 0,08mol... à moins évidemment qu'il s'agisse de 3,2g et non de 3,8g !
De toute façon : commence par écrire les équations des réactions susceptibles de se produire.
![]()
On ne nous l'a pas appris celle la mais je la garde(je me basais sur les concentration molaire pour trouver la bonne formule d'habitude)
à moins évidemment qu'il s'agisse de 3,2g et non de 3,8g !
oui je me suis tromper c'est 3,2g de NaOH
sinon l'equation est
2NaOH+HCOOH+CH3COOH => HCOONa+CH3COONa
Même s'il me semble plus clair de ne pas utiliser les formules brutes mais de laisser les écritures ioniques, l'essentiel est dans l'équation que tu as écrite. Dans ce cas particulier, le mélange est équivalent à une solution contenant 0,2mol/L de méthanoate de sodium et 0,2mol/L d'éthanoate de sodium. Il s'agit donc d'un mélange de deux bases faibles de même concentration. Comme tu sais trouver le pH d'un mélange de deux acides faibles, tu dois savoir calculer le pH d'un mélange de deux bases faibles.
Donc a chaque mélange c'est sur les produit qu'on doit se baser pour calculer le pH et non les reactifs?
Oui ici car la réaction de la soude sur les deux acides est quasi totale et que la quantité de soude ajoutée est égale à la quantité initiale d'acide. C'est le cas particulier de l'équivalence dans le cas d'un dosage acide-base. Pour visualiser cela, voici la courbe représentant (en bleu) la variation du pH du mélange en fonction de la masse m de soude ajoutée. On voit bien que le cas particulier m=3,2g correspond à l'équivalence. J'ai ajouté les courbes correspondant aux variations de concentrations des acides et de leurs bases conjuguées. On voit bien que, pour ce cas particulier, les concentrations en acides sont quasi nulles et les concentrations en bases conjuguées pratiquement égales à la concentration initiale.
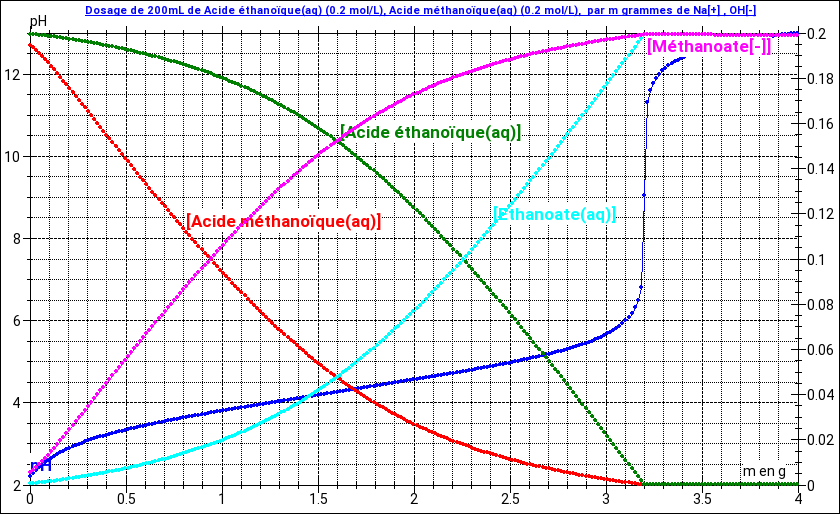
Le dernier cas correspond à ce qu'on appelle la demie équivalence. La moitié de la quantité initiale d'acide s'est transformée en base conjuguée mais attention : puisque l'acide formique n'a pas la même force que l'acide éthanoïque, cela ne veux évidemment pas dire que 50% de chaque acide s'est transformé en sa base conjuguée. Puisque le phénomène de dilution est ici négligeable, on peut juste écrire :
En tenant compte des expressions des deux Ka, je te laisse démontrer que le pH vaut la moyenne des deux pKa.
La moitié de la quantité initiale d'acide s'est transformée en base conjuguée mais attention : puisque l'acide formique n'a pas la même force que l'acide éthanoïque, cela ne veux évidemment pas dire que 50% de chaque acide s'est transformé en sa base conjuguée
en resumé c'est chaque acide qui se transforme à 50% en sa base conjugué ou la base la plus forte ?
Tu n'as pas bien compris mon message précédent. J'ai justement dit que cela n'est pas le cas. L'acide methanoique étant l'acide le plus fort des deux, plus de 50% de cet acide a réagi sur la soude alors que moins de 50% de l'acide ethanoique a réagi. Tu dois pouvoir trouver le résultat avec la relation que je t'ai fournie précédemment et les relations de définition des deux pKa.
j'y arrive pas je trouve un resultat trop complexe et je sais que je me suis perdu quelque part (j'ai jamais eu ce cas enft ).d'habitude on parle de demi equivelence lors d'un dosage
c'est quoi la relation de definition du pKa?
on parle de demi equivelence lors d'un dosage
Oui mais la situation et le calcul du pH sont analogues ici...
c'est quoi la relation de definition du pKa?
Rien de plus que les résultats du cours ; en posant h=[H3O+] pour alléger l'écriture :
Ces relation et celles déjà fournies :
devraient te conduire à :
donc pH...
dernière question : même si le C n'intervien pas dans le calcul je voudrai savoir si c'est la concentration de l'acide ethanoique?
Puisque l'énoncé fournit les constantes d'équilibre et non les pKa, tu peux effectivement laisser le résultat sous la forme :
De nombreux énoncés fournissent plutôt les pKa. Il est alors intéressant de remarquer :
Dans mes messages précédents, « c » désigne les quantités introduites par litre d'acide éthanoïque, d'acide méthanoïque et d'hydroxyde de sodium : c=0,2mol/L.
Attention : il faut tenir compte de la dilution : le mélange de 100mL de solution A et de 100mL de solution B conduit à une solution de volume 200mL, d'où la valeur de c égale à la moitié de c1 et de c2. De même, ajouter, sans variation sensible de volume, 1,6g de cristaux de soude représente une quantité introduite par litre égale à :


