Inscription / Connexion Nouveau Sujet
Acide/Base
Bonjour tout le monde,
PS: Je mets licence mais je ne suis qu'en 1ère année.
Je m'excuse de vous déranger, surtout, que, certains sont en vacances mais j'ai un problème avec un exercice de Chimie traitant des acides et des bases.
"Si on mélange 50ml H2CrO4 0,4 Mol/L avec 50 mL de NaOH O,5 Mol/L, quel sera le pH de la solution ? a) 7,0 b) 3,6 c) 12,7 d) 11,7 e) 5,9" La bonne réponse est la e) mais je ne sais pas comment trouver ce résultat. Pourriez vous m'aider s'il vous plait ?
Histoire de venir avec quelques réflexions, j'ai remarqué que dans notre exercice, on a un acide diprotique.
Nous avons donc deux équations :
H2CrO4 + H20 --> HCrO4- + H3O+.
HCrO4- + H20 --> CrO42- + H3O+.
Le pKa de H2CrO4/HCrO4- vaut 0,8 et le pKa de HCrO4-/CrO42- vaut 6,4.
Donc, avec mes calculs, j'ai déduit que nous étions au delà du 1er point d'équivalence, car, à ce moment là, le pH = 3,6. De plus, à mi chemin entre les deux points équivalents (la 2ème demi équivalence), le pH = 6,4. Hormis ça, je n'ai rien trouvé de plus ...
Bonne soirée et un grand merci à ceux qui m'aideront ! 
Bonjour
Tu as déjà bien cerné le problème en remarquant que la situation étudiée est comprise entre la première et la seconde équivalence.
La première réaction est quasi totale ; la première équivalence correspond à un volume de solution de soude ajoutée égal à : Ve1=40mL.
Tu peux donc considérer que le pH final est celui dû à la réaction quasi totale entre les 10mL de soude restant à la première équivalence et les 0,02mole d'acide HCrO4- formés à la première équivalence. Rempli un tableau d'avancement puis utilise la formule bclassique :
Remarque : tu n'as même pas à calculer les concentrations en tenant compte de la variation de volume : le rapport de deux concentrations pour une même solution est égal au rapport des deux quantités de matière.
Remarque : sans faire le moindre calcul, les remarques précédentes conduisent à un pH un peu inférieur à pKa2=6,4... Cela est sans doute suffisant pour un QCM...
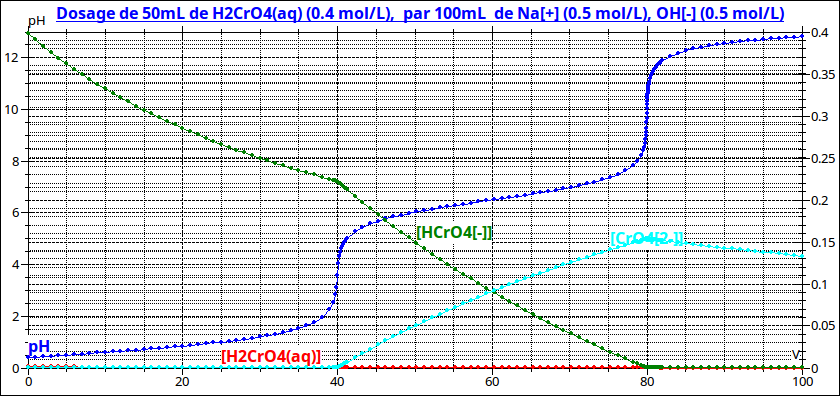
Voici pour t'aider les courbes représentant en fonction du volume de soude ajouté, le pH et les trois concentrations... Tu n'as plus qu'à lire le résultat correspondant à un volume de soude ajouté de 50mL.