Inscription / Connexion Nouveau Sujet
500mL + 500mL...pas 1L
Bonjour,
On étudie le mélange eau éthanol, et on veut faire un mélange de 1L à 50% en volume d'éthanol.
Dans une première partie, on a vu que 500mL + 500mL ne faisait pas 1L. Pour ce faire, on a du calculer la fraction molaire en éthanol qui est de 0.24.
Pour la seconde partie, on veut calculer quel volume il faut réellement mélanger, pour obtenir 1L de solution à 50% en volume d'éthanol. Et on garde la fraction molaire de 0.24, et je ne comprend pas pourquoi, alors que tout change. Si qqn saurait m'expliquer.
Merci
il faut connaître la masse volumique du mélange à 50%,ainsi que la masse volumique de l'alcool a 95°
A priori ,la première partie doit te fournir ces valeurs.
En regardant dans des tables de données,j'ai trouvé 930 g/l pour le mélange à 50%
soit x(A) la fraction molaire de l'alcool dans un mélange à 50% .
n(A)/n(total)=0,24
et pour 1 L de solution m=930g
donc
930= n(A)*M(A) +n(E)*M(E).
C'est à partir de ces équations que je résoudrais le problème.
A confirmer cependant!
On l'a fait en cours, cet exo j'ai les résultats en faite (merci à toi), mais je comprend pas : les 50% sont 50% en volume avant mélange, ou 50% en volume après mélange ?
Et pourquoi, on garde cette fraction molaire qui dépend des Vm qui eux varient?
bonjour,
50% V/V signifie 50 mL d'alcool pur dans 100 mL de solution.
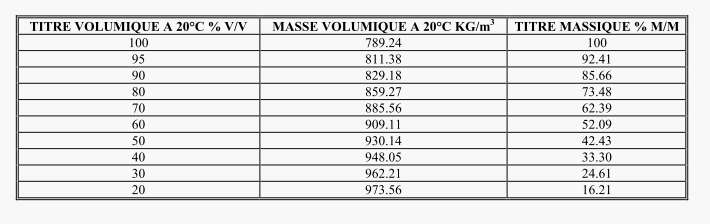
je te joins le tableau de données que j'ai utilisé pour trouver la masse volumique de la solution à 50%
On voit que pour une solution à 50% V/V la masse d'alcool pur est 42,43 g pour 100g de solution .Il y a donc 57,57g d'eau dans 100g de solution.
dans 100g de solution:
n(A)= 42,43/46=0,922 mol
n(E)=57,57 /18 =3,12 mol
n(total)=4,12 mol
x(A)= 0,922/4,12=0,224 et non 0,24 comme dans ton énoncé .
D'autre part ,dans mon premier post ,j'ai supposé qu'on utilisait de l'alcool absolu.
Peux tu me donner les résultats?
J'ai un pb avec le tableau,je te le transmet après
une autre façon de résoudre
dans 50 mL d'éthanol il y a 39,46 g d'éthanol soit0,858 mol
si n(A)/n(total)=0,224 , n(total)=3,829
n(eau)=2,97 mol soit 53,5 g
pour avoir 1 L d'alcool à 50% on mélange 500mL d'alcool et 535 mL d'eau
sauf erreur de ma part!