Inscription / Connexion Nouveau Sujet
Temps et evolution chimique
Bonjour
pourriez vous me dire cela est juste
Merci
On étudie, par suivi spectrophotométrique, la transformation entre les ions permanganate
2MnO -4 + 5 H2C2O4 + 6 h+ 2 Mn2+ + 10 CO + 8H20
Seuls les ions permanganates sont colorés.
On dispose d'un volume V1 = 1,00 mL d'une solution aqueuse de permanganate de potassium de concentration c1 = 8,00.10-4 mol.L-1, acidifiée.
On le mélange à un volume V2 = 1,00 mL d'une solution aqueuse d'acide oxalique de concentration c2 = 3,00.10-2 mol.L-.1
On mesure l'absorbance A à la longueur λm = 590 nm au cours du temps.
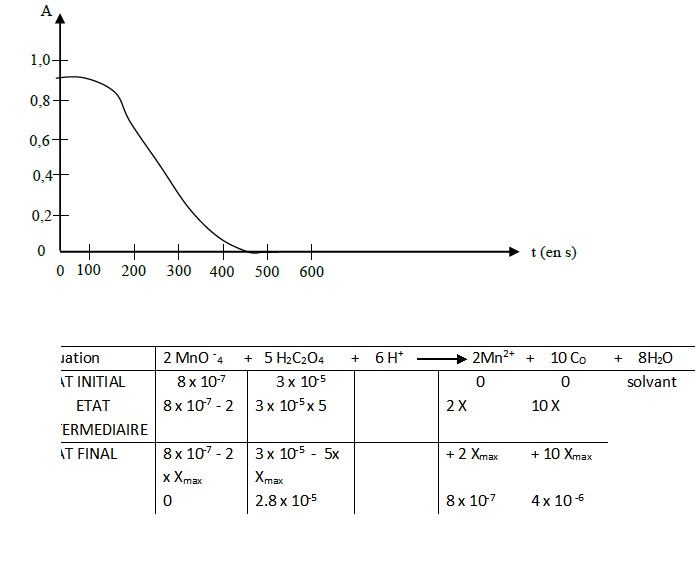
Les résultats sont reportés sur le graphique suivant :
1. Calculer les concentrations initiales en ions permanganate et en acide oxalique.
V3 = V1 + V2
V3 + 2 ml = 0.002 l
Cinitiale de MnO -4 = n 1 + 0/ V3 = (C1 x V1) + 0/V3
Cinitiale de MnO -4 = 8,00.10-4 x 0.001 /0.002
Cinitiale de MnO -4 = 4 x 10-4 mol.L-1
Cinitiale de H2C2O4 = n2/V3 = n 2 + 0/V3 = (C2 x V1) + 0/V3
Cinitiale de H2C2O4 = 3,00.10-2 x 0.001 / 0.002
Cinitiale de H2C2O4 = 0.015 mol.L-1
2. Etablir le tableau d'avancement de la transformation chimique en fonction de c1, V1, c2, V2 et x l'avancement de la réaction dans un état intermédiaire quelconque. Faire apparaître l'état initial, l'état intermédiaire et l'état final.
3. Calculer la valeur de l'avancement final xf. Déterminer le réactif limitant.
Quantité de matière dans l'état initial :
n H2C2O4 = 3 x 10-2 x 0.001 = 3 x 10-5 mol
n MnO -4 = 8 x 10-4 x 0.001 = 8 x 10-7 mol
VOIR TABLEAU PIECE JOINTE
Si le réactif limitant est MnO4-, alors 8 x 10 - 7 - 2 Xmax = 0 ce qui donne Xmax = 4 x 10 - 7 mol.
Si le réactif limitant est H2C2O4 , alors 3 x 10 - 5 - 5 Xmax = 0 ce qui donne Xmax = 6 x 10 - 6 mol
L'avancement maximale = 4 x 10-7 et le réactif limitant est le permanganate
4. Etablir la relation entre l'absorbance A, le coefficient d'absorption molaire Ԑ, la largeur l de la cuve et la concentration MnO4- à la date t. ...
A = Ԑ x l x CMnO4-
5. En exploitant le graphique, calculer Ԑ.l
je ne comprend pas
6. Montrer, grâce au graphique, que les ions permanganate sont le réactif limitant de la réaction.
Le réactif limitant est le permanganate puisque nous pouvons observer qu'il diminue au cours du temps grâce à la courbe qui nous permet d'observer une diminution du taux d'absorbance du permagante qui est proportionnel à sa concentration
7. Définir le temps de demi-réaction t1/2. Déterminer sa valeur.
Le temps de demi-réaction t1/2 est le temps pour que l'avancement atteigne la moitié de sa valeur finale
500 / 2 = 250 s
Bonsoir
OK pour tes calculs et le tableau d'avancement mais tu n'exploites pas suffisamment la courbe fournie.
5. Il faut appliquer la formule de Beer Lambert dans le cas particulier t =0. À cette date, tu connais la concentration en ions permanganate et tu peux déterminer la valeur de A graphiquement.
6. Si l'ion permanganate n'était pas le réactif limitant, la solution resterait colorée en fin de réaction. On obtiendrait A strictement positif pour t tendant vers l'infini et non zéro.
7. A étant proportionnelle à la concentration en ions permanganate, le temps de demi réaction correspond à une valeur de A égale à la moitié de la valeur initiale. Lecture graphique...


