Inscription / Connexion Nouveau Sujet
Suivi cinétique d'une réaction et temps de demi-réaction
Bonjour,
Je suis actuellement en train de faire un exercice, mais je suis bloquée...
Voici l'exercice :
On vend en pharmacie sous le nom de Lugol, un antiseptique à base de diiode. On rappelle que les solutions de diiode sont brunes. On plonge dans cette solution une lame de zinc. On donne les couples oxydant/réducteur suivants :
Zn2+(aq)/Zn et I2/I- (aq)
1. a) Ecrire l'équation de la transformation chimique qui a lieu entre le diiode et le zinc
Voici ce que j'ai répondu : I2 + Zn ---> 2I- + Zn2+
b) Comment évoluent la coloration du milieu et la masse de la plaque de zinc au cours du temps?
Ma réponse: L'évolution est lente, la coloration brune du diiode s'atténue au cours du temps, et la masse de la plaque de zinc diminue au cours du temps
Pour étudier la cinétique de la réaction, on suit l'évolution de la concentration en diiode au cours du temps. Pour cela on réalise des prélèvements du milieu réactionnel à intervalle de temps régulier et on dose le diiode restant dans la solution.
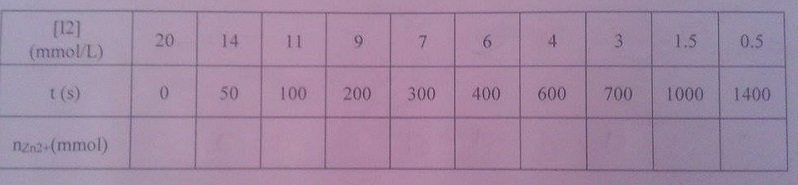
Pour cette expérience, la T° du milieu réactionnel est de 22°C et la concentration initiale en diiode est de Co = 0,02 mol/L. On obtient le tableau suivant : (image)
2. En s'aidant éventuellement d'un tableau d'avancement, calculer la quantité d'ions Zn2+ au cours du temps et remplir la troisième ligne du tableau
Je suis bloquée ici, je ne sais pas comment faire....
J'espère que vous pourrez m'aider,
merci beaucoup
Bonjour 
OK pour les deux premières questions 
Connais-tu le volume de la solution ? Et as-tu réussi à faire le tableau d'avancement de la réaction ?
Florian
Bonjour,
Non je ne connais pas le volume de la solution
Et je ne comprend pas pourquoi faire un tableau d'avancement ?
Comme l'a expliqué Florian, il est impossible de déterminer la quantité d'ions zinc sans connaître le volume de la solution. Puisqu'il s'agit, j'imagine, d'un exercice d'entraînement, pas d'un devoir à rendre, tu peux te fixer arbitrairement une valeur réaliste du volume ; par exemple : V = 100mL.
Et je ne comprend pas pourquoi faire un tableau d'avancement ?
Comment fais-tu habituellement pour obtenir une relation entre les quantités de réactifs qui disparaissent au cours de la réaction et les quantités de produits formés ?
Bonjour,
Si justement, c'est un devoir à rendre pour mon entrée en prépa, et aucun volume n'est indiqué...
Explique que la quantité n d'un produit se déduit de la concentration et du volume de la solution par la relation : n = c.V ;
Ici, tu peux déterminer c mais pas n si V est inconnu.
Deux solution pour toi :
- 1° : faire comme indiqué dans mon message précédent en imposant un volume arbitraire : V = 100mL par exemple ;
- 2° : modifier la question 2) de la façon suivante :
2. En s'aidant éventuellement d'un tableau d'avancement, calculer la concentration en ions Zn2+ au cours du temps et remplir la troisième ligne du tableau .
La troisième ligne du tableau sera alors : [Zn2+] (mmol/L)
D'accord, merci beaucoup pour vos conseils.
Je pense que je vais imposer un volume arbitraire, en expliquant qu'aucun volume n'est donné dans l'énoncé de l'exercice
Je te présente mes excuses. J'avais mal lu le début de l'énoncé dans la mesure où il ne posait pas de problème. Le dosage des ions iodure se fait par prélèvements successifs et non par spectroscopie comme souvent. Le volume réactionnel ne reste donc pas fixe. Cette situation n'est pas normalement au programme ! Sans indications sur les volumes présents a chaque date les calculs de quantités sont impossibles. ..
Je me pose des questions sur l'auteur de cet exercice...
Bref , essaie d'expliquer cela et si tu tiens à calculer des quantités , precise bien qu'il s' agit des quantités fictives que l'on aurait obtenues en maintenant le volume fixe à une valeur que tu préciseras. Sinon, contente toi d'un calcul de concentration
En fait ce sont des exercices pour une entrée en prépa, ce n'est peut être pas au programme de Tle mais je suis sans doute cessée savoir le faire et me débrouiller... Je ne sais pas
Dans tout les cas, je vous remercie pour vos réponses, je vais pouvoir avancer dans mon problème
Cordialement
Salut !
J'ai trouvé sur Internet le même exercice mais avec le volume de noté: Je suis d'accord qu'il s'agit d'un oubli (intentionnel ou non ça je ne sais pas, car l'objectif peut aussi être de t'habituer à prendre des décisions lorsque tu rencontres de erreurs dans les sujets, chose fréquente en prépa) 
Le volume serait de 50 mL. Par contre, le lycéen dit un peu n'importe quoi.... x)
Lien où l'info a été trouvée:
http://forums.futura-sciences.com/chimie/244546-exercices-dentrainement-terminale-s.html
Bon courage !
Geogeos


