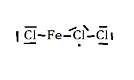Inscription / Connexion Nouveau Sujet
Représentation de Lewis du FeCl3
Bonjour
Pourriez vous m'aider pour la représentation de Lewis du FeCl3 car je n'y arrive pas? Merci.
Bonjour et désolé du retard.
Je sais que Fe a 1 doublet non liant si on fait sa représentation de Lewis.
Je sais aussi que Cl a 3 doublets non liants +1 électron célibataire si on fait sa représentation de Lewis.
Ce que je n'arrive pas à faire c'est la représentation de Lewis du FeCl3.Je sais seulement que cette molécule contient 11 paires + 1 électron célibataire.
J'ai donc essayé et je trouve ceci.Et désolé pour ce dessin pas très beau.
Fe a combien de doublets liants ?
OK pour Cl : 3 doublets non liant et 1 doublet liant --> il y a donc un truc bizarre dans ta représentation de Lewis

Et pourtant les électrons de valence sont respectés c'est à dire qu'il faut 2 électrons de valence pour le Fe et 7 électrons de valence pour chaque Cl.Par contre, la règle de l'octet n'est pas respectée partout.Sinon Fe a 0 doublet liant et 1 doublet non liant si on fait sa représentation de Lewis.