Inscription / Connexion Nouveau Sujet
problèmes scientifiques (eau potable ?)
Bonjour à tous toutes ,
J'ai un problème scientifique voici le sujet :
***Liens supprimés***
Problème :
Une expérience a permis de mesurer l'absorbance de la solution S eau :
A eau = 0.366
L'eau est t'elle potable ?
Données :
(NO3-) + (4H+) + (3e-) = NO+2H2O
Cu = (Cu2+) + (2e-)
(j'ai rajouté des parenthèses pour éviter de confondre les charges avec les + ou -)
Mon travail : j'ai calculé les demi équations d'oxydoréduction :
(NO3-) + (4H+) + (3e-) = NO+2H2O (x2)
Cu = (Cu2+) + (2e-) (x3)
(2No3-) + (8H+) + (3Cu) = 2 No + 4 H2o + (3Cu2+)
ainsi on obtient l'équation de la réaction entre le métal cuivre et les ions nitrate
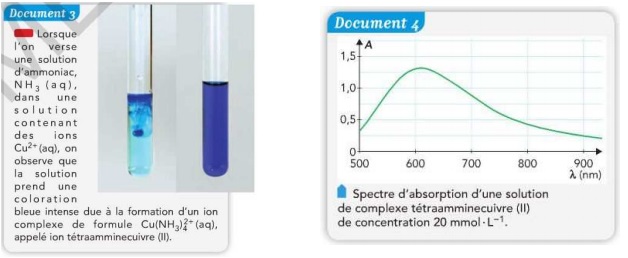
La loi de Beer Lambert peut nous permettre de savoir la concentration grâce au document 4 avec la longueur d'onde = 610nm on a une absorbance de 1.31 d'ou
A = k x c c = 1.31/610 = 2,14 x 10 -3 mol/L
après par la suite je suis perdu le doc 1 nous donne une
concentration massique 50x10-3 g/L
une concentration = 2,14 x 10 -3 mol/L
il me faudrait une masse molaire , une masse , volume pour calculer la concentration massique : c x M ou m/V et après je sais plus quoi faire .
Merci pour vous réponses dans le forum
document 2 désoler pour la sélection et la qualité il fallait que sa rentre sur les critères du site

bonsoir,
La loi de Beer Lambert peut nous permettre de savoir la concentration grâce au document 4 avec la longueur d'onde = 610nm on a une absorbance de 1.31 d'ou
A = k x c c = 1.31/610 = 2,14 x 10 -3 mol/L
Le document 4 indique que l'absorbance des solutions d'ions Cu2+, complexés par NH3 , sera maximale pour une longueur d'onde de 610 nm.Cette longueur d'onde n'a rien à faire dans le calcul ci-dessus.
Quelques remarques préliminaires:
les ions nitrates sont incolores et ne peuvent pas être dosés directement par colorimétrie.
Les ions Cu2+ complexés peuvent être dosés par colorimétrie
On peut oxyder le cuivre en Cu2+ par l'action des ions nitrates.
Il y a un lien entre la concentration en Cu2+ et la concentration en nitrate .Ce lien est donné par l'équation
2NO3-) + (8H+) + (3Cu) = 2 No + 4 H2o + (3Cu2+),c'est à dire
n(NO3-)/2= n(Cu2+)/3
L'idée du dosage colorimétrique est la suivante:
on va oxyder du cuivre par les ions nitrates contenus dans 5mL d'eau polluée.
on va complexer les ions Cu2+ obtenus par NH3
on va trouver la concentration en Cu2+ complexés en utilisant une gamme étalon.
On utilise ce résultat pour retrouver la concentration en NO3- de l'eau polluée puis on calcule la masse de NO3- par litre .
en pratique :
on prépare une gamme étalon en Cu2+ complexé à partir de S0
il faut donc calculer les concentrations de S0,S1,S2,S3
On trace la représentation graphique de A= f(C) A étant l'absorbance et C les concentrations de S0,S1,S2,S3
On trouve expérimentalement que la solution Seau à une absorbance de 0,366.
Graphiquement on peut trouver la concentration en Cu2+ de Seau.
ces ions Cu2+ étaient contenus dans 100mL de solution
donc n(Cu2+) = .... dans 100mL
Sachant que ces Cu2+ vienne de l'oxydation de Cu par NO3- ,on peut calculer la quantité de matière de NO3- ayant réagi (voir la relation entre n(NO3-)et n(Cu2+)
Cette quantité de NO3- provenait de 5 mL d'eau.
On peut donc calculer la concentration de NO3- dans 1 L d'eau polluée ,puis la masse de NO3- par litre.
J'espère que ces explications te seront utiles