Inscription / Connexion Nouveau Sujet
pression et volume de gaz

salut ,
j'ai un probleme que j'ai essayer de résoudre et je voudrais savoir si ma résolution est juste et et si il y a d'autres méthodes.
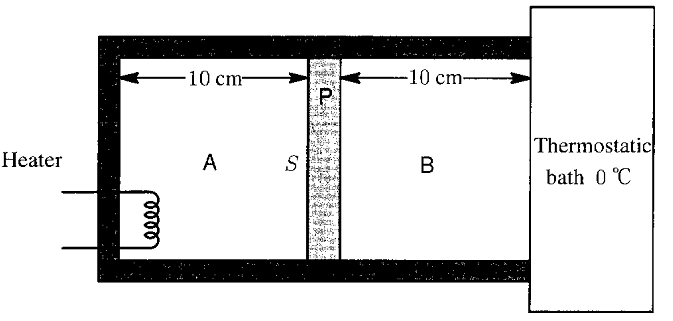
nous avons un cylindre fermé separé en deux partie (A,B)par un piston la longeur de chaque section est de 10 cm chaque section contient un gaz monoatomique a 0 dégrés Celsius et a un pression de 1 . 1O5Pa tout deux contenant le meme type de gaz. Le gaz en B est en contact avec un bain thermostatic a 0 dégrés Celsius et ne change pas en temperature
le piston et le contenant ne conduisent pas la chaleur le piston a une surface S et il n'y a pas de friction entre le piston et le contenant hermétiquement scellé quand le gaz en A est chauffé a une température de 57 dégrés Celsius quelle est la distance parcourue par le piston P?
voila ma resolution
57 C = 330 K (K degre kelvin)
0 C = 273 K
apres le deplacement on
PA : pression en A ,PB : pression en B
Va : volume du gaz en A Vb : volume du gaz en B
je suppose que puisqu'il y a equilibre on a PA =PB
PA * Va = PA * Vb
avant d'aller plus loin j'aimerais savoir si cette supposition est vrai ?
Bonjour 
On suppose que les deux gaz peuvent être considérés comme étant des gaz parfaits. En reprenant tes notations on a donc, au début de l'expérience :
Pa : Pression dans le compartiment A
Va : Volume dans le compartiment A
Na : Quantité de matière dans le compartiment A
Ta : Température dans le compartiment A
Pb : Pression dans le compartiment B
Vb : Volume dans le compartiment B
Nb : Quantité de matière dans le compartiment B
Tb : Température dans le compartiment B
(On pourra ensuite prendre les mêmes notations, indicées Pa', Ta' etc., pour parler des conditions lorsque le nouvel état d'équilibre est atteint).
Tu as raison d'affirmer que Pa = Pb avant le début de l'expérience. En effet, les forces s'exerçant sur le piston du côté A et B se compensent, et on a donc : Fa = Fb <=> Pa . S = Pb . S <=> Pa = Pb. On aura d'ailleurs la même égalité lorsque le nouvel état d'équilibre est atteint (Pa' = Pb').
On peut ensuite écrire la relation d'état des gaz parfaits en A et B avant le début de l'expérience :
Pa . Va = Na . R . Ta
Pb . Vb = Nb . R . Tb
Comme Pa = Pb et Ta = Tb et Va = Vb on a donc aussi :
Na = Nb
Et l'autre relation que tu as donnée est donc aussi correcte : Pa . Va = Pb . Vb.
Attention par contre, on aura pas à priori : Pa' . Va' = Pb' . Vb'.
Je te conseille pour la suite de l'exercice d'également adopter cette notation :
Va = S . xA ; Va' = S . xA'
Vb = S . xB ; Vb' = S . xB'
Et on aura donc :
xA + xB = 20
xA' + xB' = 20
Tu peux désormais écrire la relation d'état pour le gaz compris dans le compartiment A et celui dans le compartiment B lorsque le nouvel état d'équilibre est atteint. Qu'obtiens-tu alors ?
J'espère que cela aura pu t'aider un peu.
Florian
je suppose que puisqu'il y a equilibre on a PA =PB
PA * Va = PA * Vb
OUI pour "je suppose que puisqu'il y a equilibre on a PA =PB"
Mais NON pour "PA * Va = PA * Vb"
Où tiens-tu compte que les température finales en A et B sont différentes ?

puisque PA = PB
voici ma resolution
Ta : temperature en A
Tb temperature en B
PA * Va = n * R* Ta
PB * Vb = n * R * Tb or PA = PB  PA * Vb = n * R * Tb
PA * Vb = n * R * Tb
n * R = (PA * Va )/ Ta = (PA * Vb )/ Tb
 Va / Ta = Vb / Tb Ta = 330 K et Tb = 273 K
Va / Ta = Vb / Tb Ta = 330 K et Tb = 273 K
Va = (330/ 273) Vb
on a S la surface du piston donc Va = S * (l + 10) (l : la variation de la longueur apres le deplacement)
Vb = S * (10 - l )
[S * (l + 10) ] / [ S * (10 - l ) ] = (330/ 273)
(l + 10) / (10 - l) = (330/ 273) = 1.2
12 - (1.2 * l) = 10 + l  2.2 * l = 2
2.2 * l = 2
l = 2 / 2.2 = 0.90 cm
dite moi si c'est juste et si il y a une autre methode plus facile
Ta méthode me semble être correcte.
On a bien :
Pa' . Va' = Pa' . S . (l + 10) = Pb'. Vb' / Tb' . Ta'
En simplifiant on a donc bien :
(l + 10) = (10 - l) . (Ta'/Tb')
Ce qui donne l'équation suivante à résoudre :
(l + 10)/(10 - l) = Ta'/Tb'
Par contre mon application numérique me donne : l = 0,94 cm
Je pense que la petite erreur que tu as réalisée est la suivante : tu as utiliser la valeur de 1,2 que tu as réinjecter dans l'équation (l + 10)/(10 - l) = Ta'/Tb' au lieu d'utiliser la valeur exacte du rapport Ta'/Tb'. Sur ta copie il est très bien d'indiquer que Ta'/Tb' = 1,2 (afin de respecter le nombre de chiffres significatifs) mais fais bien attention à réutiliser la valeur exacte de ce rapport pour la suite de ces calculs. Et deuxième petit détail : T (K) = T(°C) + 273,15.
A part cela tout est très bien. Et mes conseils à la fin ne sont pas là pour t'embêter, juste des conseils pour parfaire davantage ton travail. 
Si tu as d'autres questions n'hésite pas.
Florian



